O experimento de Rutherford foi utilizado para contestar o modelo atômico de Thomson, conhecido como “pudim de passas”. Nesse experimento, Ernest Rutherford e sua equipe constataram que o átomo era constituído principalmente de espaço vazio e, além disso, um núcleo pequeno, denso e maciço. A seguir, aprenda mais sobre esse experimento e o que foi comprovado com sua realização.
Publicidade
O que foi o experimento de Rutherford
Em 1911, o físico Ernest Rutherford e sua equipe realizaram um experimento que revolucionou o modo como a estrutura atômica era compreendida. Até o momento, o modelo aceito era o de Thomson, no qual o átomo era constituído de um núcleo maciço com carga positiva e cargas negativas estavam grudadas em sua superfície. No entanto, ao realizar o experimento para estudar a trajetória de partículas alfa (α) com materiais sólidos, pôde constatar que a estrutura atômica diferiria da proposta.
Relacionadas
O experimento consistia em uma caixa metálica de chumbo que continha um material radioativo e emissor de partículas alfa. Na frente dessa caixa, havia uma lâmina fina de ouro, com 10-4 mm de espessura, além de um anteparo circular recoberto com uma camada de sulfeto de zinco, utilizada como detector, visto que esse composto fluorescia quando exposto às partículas α. Na imagem abaixo, veja uma representação do experimento:
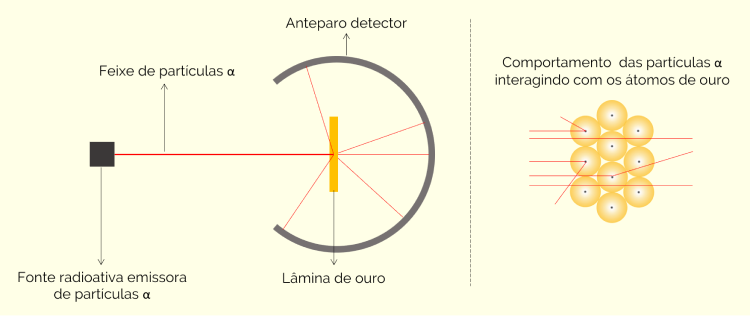
Ao final do experimento, foi possível observar que a maioria das partículas realmente passava direto pela folha de ouro, como já era de se esperar. Porém, algumas desviavam o caminho e outras, uma minoria, era refletida. A conclusão tomada, portanto, foi de que a maior parte do núcleo é vazia, por onde as partículas α passavam. Outra parte, bem menor, era maciça e fazia com que tais partículas fossem desviadas ou refletidas. Essa conclusão também pode ser vista na imagem anterior.
O que o experimento de Rutherford comprovou
Sendo assim, o experimento foi muito importante para o estudo atômico e comprovou que o modelo proposto anteriormente por Thomson era equivocado. O átomo, na verdade, é formado majoritariamente de espaços vazios, que permitiram a passagem livre da maioria das partículas α. Além disso, há um núcleo maciço, que promoveu o desvio e reflexão de uma parte das partículas.
Como já se tinha conhecimento de que as partículas α possuem uma unidade de carga positiva, o desvio aconteceu por conta de repulsão entre cargas iguais, visto que a hipótese era de que o núcleo também tinha carga positiva.
Publicidade
Entretanto, o modelo proposto por Rutherford não era completamente correto, visto que ainda deixou a dúvida com relação à estabilidade do núcleo atômico. Se ele era composto de cargas negativas, como átomos com maiores massas atômicas são estáveis com tantas cargas positivas acumuladas no mesmo espaço? A repulsão de cargas não permitiria isso. Tal questionamento só foi respondido com o modelo atômico de Rutherford-Bohr que introduziu o conceito dos nêutrons no núcleo, que estabilizam as cargas.
Vídeos sobre o experimento de Rutherford
Agora, veja alguns vídeos selecionados para ajudar a assimilar o conteúdo estudado e visualizar como o experimento foi realizado:
O modelo atômico experimental de Rutherford
Publicidade
Apesar de não estar correto, o modelo de Rutherford para o átomo foi revolucionário para a ciência, visto que foi introduzido o conceito de orbitais, região onde os elétrons se encontram e rodeiam o núcleo. Veja como foi, para os pesquisadores da época, essa descoberta e como foi realizado o experimento de Rutherford.
As conclusões do experimento de Rutherford
Ao realizar esse experimento, Rutherford concluiu que o átomo é constituído de um núcleo positivo rodeado pelos elétrons, que possuem carga negativa, numa região que ocupa a maior parte do volume dessa partícula. Veja como foi realizado esse experimento, que mudou a maneira que os cientistas enxergavam os átomos.
O modelo de átomo praticamente vazio
Até o ano de 1911 acreditava-se que o átomo era como um pudim de passas, conforme o modelo atômico de Thomson. Porém, nesse ano, Rutherford e sua equipe realizaram um experimento e provaram o contrário. Na verdade, o átomo é constituído de um núcleo pequeno, que abriga a toda a massa da partícula, e os elétrons se encontram num espaço vazio ao redor desse núcleo. Veja no vídeo mais detalhes do modelo atômico de Rutherford.
Em síntese, o experimento de Rutherford, realizado bombardeando partículas radioativas em uma lâmina de ouro, foi essencial para o estudo da atomística e introduziu o conceito de que um átomo é constituído majoritariamente de espaço vazio e seu núcleo é extremamente pequeno e maciço. Não pare de estudar por aqui, aprenda sobre outra região dos átomos, a eletrosfera.
Referências
Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente (2005) – Peter Atkins e Loretta Jones
Química: a ciência central (1999) – Theodore L. Brown, Eugene H. LeMay, Bruce E. Bursten e Julia R. Burdge
Química Inorgânica(1992) – Peter Atkins, Duward F. Shriver e Cooper H. Langford

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Experimento de Rutherford. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/experimento-de-rutherford. Acesso em: 07 de February de 2026.
1. [PUC]
Uma importante contribuição do modelo de Rutherford foi considerar o átomo constituído de:
a) elétrons mergulhados numa massa homogênea de carga positiva.
b) uma estrutura altamente compactada de prótons e elétrons.
c) um núcleo de massa desprezível comparada com a massa dos elétrons.
d) uma região central com carga negativa chamada núcleo.
e) um núcleo muito pequeno de carga positiva, cercada por elétrons.
Por seu experimento, Rutherford pôde concluir que a maior parte do átomo é vazia e seu núcleo, onde se encontram as cargas positivas, é extremamente pequeno e denso. Sendo assim, a alternativa correta é a letra e) um núcleo muito pequeno de carga positiva, cercada por elétrons.
2. [UCDB-MT]
No modelo atômico de Rutherford, os átomos são constituídos por um núcleo com carga ……, onde …… estaria concentrada. Ao redor do núcleo estariam distribuídos os ….. . A alternativa que completa corretamente a frase é:
a) negativa – toda a massa – elétrons.
b) positiva – metade da massa – elétrons.
c) positiva – toda a massa – elétrons.
d) negativa – toda a massa – nêutrons.
e) positiva – toda a massa – nêutrons.
Completando as lacunas, a frase correta fica: “No modelo atômico de Rutherford, os átomos são constituídos por um núcleo com carga positiva, onde toda a massa estaria concentrada. Ao redor do núcleo estariam distribuídos os elétrons.”
Sendo assim, a alternativa correta é a letra c) positiva – toda a massa – elétrons.