Apesar de o termo remeter a grandes desastres nucleares, como o de Chernobyl ou o Césio-137 em Goiânia, a radioatividade é aplicada no cotidiano em diversas áreas. É um fenômeno que ocorre no núcleo de átomos instáveis que atingem a estabilidade por emissão de partículas específicas. Veja detalhadamente o que é, além de características e aplicações da radioatividade.
Publicidade
O que é radioatividade
A radioatividade é um fenômeno nuclear em que átomos de núcleos instáveis emitem radiação na forma de onda eletromagnética ou de partículas. Difere de uma reação química, visto que esta ocorre na eletrosfera dos átomos e não no núcleo. Um átomo radioativo, por conta da perda das partículas, pode se transformar em outro elemento químico
Relacionadas
Esse fenômeno foi descoberto e descrito pela primeira vez pelo francês Henri Becquerel ao investigar a fosforescência de materiais em 1896. Mais tarde, Pierre e Marie Curie se dedicaram ao estudo de emissões radioativas. Desse estudo, Marie fez a descoberta, em 1898, de dois elementos químicos novos e radioativos e foi premiada por tal fato. Ainda nesse ano, após experimentos, Ernest Rutherford constatou que elementos radioativos fazem a emissão de partículas de cargas negativa e positiva.
Nem todos os elementos da tabela periódica são radioativos, somente aqueles que buscam a estabilidade nuclear. Depois da emissão da radiação, os átomos se tornam mais leves ou estáveis. Esse processo é conhecido como decaimento radioativo.
Decaimento radioativo
O decaimento radioativo é justamente o processo de emissão da radiação por um átomo instável. A medida que essa emissão ocorre, o átomo se transforma em outro elemento (seu número atômico muda). Ele é a diminuição da atividade radioativa do elemento e mensurado pelo tempo que demora para que essa atividade decaia pela metade é chamada de tempo de meia vida, ou período de semi desintegração.
Ele ocorre naturalmente com elementos químicos de número atômico (Z) maior que 85, por conta da abundância de prótons no núcleo que passa a ser instável. O núcleo sofre o decaimento radioativo até que o número atômico seja menor que 84, visto que os nêutrons não são capazes de estabilizar todos os prótons de átomos que têm o Z maior que 85.
Publicidade
Tipos de radioatividade
A emissão radioativa, ou seja, a radiação, se apresenta de duas formas principais: em partículas (alfa e beta) ou em ondas eletromagnéticas (gama). Cada uma tem suas características, veja com mais detalhes.
Radiação alfa (α)
São partículas pesadas, com carga igual a +2 e massa de 4 u. Constituída de dois prótons e dois nêutrons, pode ser comparada ao núcleo do átomo de Hélio, motivo pelo qual alguns autores chamam a partícula alfa de “hélion”. É a radiação com menor poder de penetração, podendo ser barrada por uma folha de papel, portanto os danos causados aos seres vivos são baixos.
Radiação beta (β)
São partículas de carga negativa de valor -1 e com massa desprezível. Na verdade, a radiação β é um elétron, que surge e é emitido ao ocorrer um rearranjo do núcleo do átomo que busca a estabilidade. Seu poder de penetração é cerca de 50 a 100 vezes maior que o das partículas α, então atravessam folhas de papel, porém são detidos por chapas de alumínio de 2 cm de espessura. No corpo humano, não atinge órgãos vitais, mas consegue penetrar uma distância de 1 a 2 cm da pele, podendo causar queimaduras.
Publicidade
Radiação gama (γ)
Essa radiação difere das anteriores por ser uma onda eletromagnética altamente energética, sem massa ou carga elétrica. É emitida pelo núcleo dos átomos radioativos depois da saída de partículas α ou β. Possui um elevado poder de penetração, sendo detida somente por placas de chumbo ou blocos de concreto de pelo menos 5 cm de espessura. Por conta disso, causa danos irreparáveis às células do corpo humano.
Dessa forma, conforme o átomo emite radiação, ele se desintegra e se transforma em outro átomo, com maior estabilidade nuclear. É importante notar que até mesmo um elemento emissor de partículas α, que não causam danos à nossa saúde, pode ser perigoso, pois ele também acaba emitindo radiação γ no processo.
Leis da radioatividade
A emissão de radioatividade segue alguns princípios e comportamentos que são explicados pelas duas leis da radioatividade, propostas por Frederick Soddy (químico inglês) e por Kazimierz Fajans (químico e físico polonês). Uma das leis descreve o comportamento das partículas α e a outra das partículas β.
Primeira lei
A primeira lei da radioatividade diz que quando um radioisótopo (isótopo radioativo) emite uma partícula α, ele dá origem a um novo elemento com uma redução de 4 unidades de massa atômica (A) e 2 unidades de número atômico (Z). O fenômeno é observado na equação genérica abaixo.
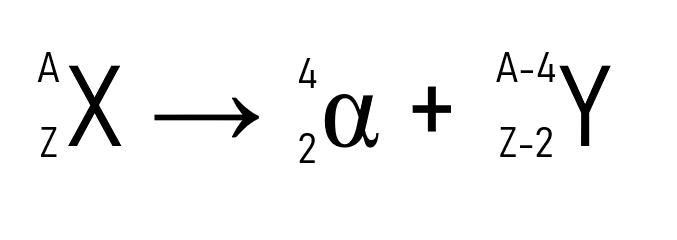
Um exemplo que demonstra essa lei é o da emissão radioativa do plutônio (A = 242 u e Z = 94). Depois da emissão da partícula α, o elemento formado é o urânio (A = 238 u e Z = 92).
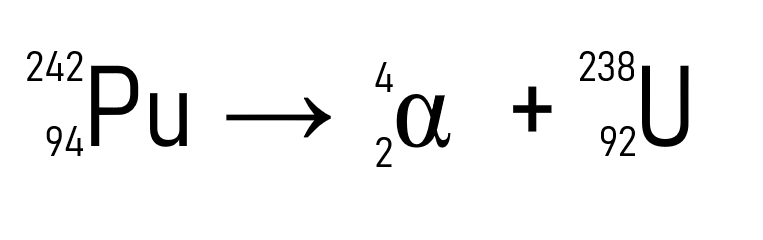
Segunda lei
A segunda lei da radioatividade diz respeito à emissão de partículas β. Se um elemento radioativo emite uma partícula β em seu decaimento, seu número atômico (Z) sofre o aumento de uma unidade, mas sua massa atômica (A) permanece inalterada. Está representado abaixo.
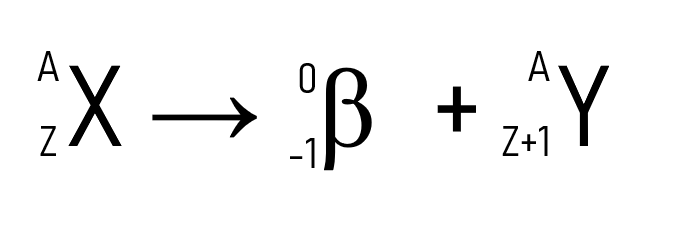
Por exemplo, o tório (A = 234 u e Z = 90) ao emitir uma partícula β passa a ser o protactínio, que possui a mesma massa atômica, mas Z = 91.
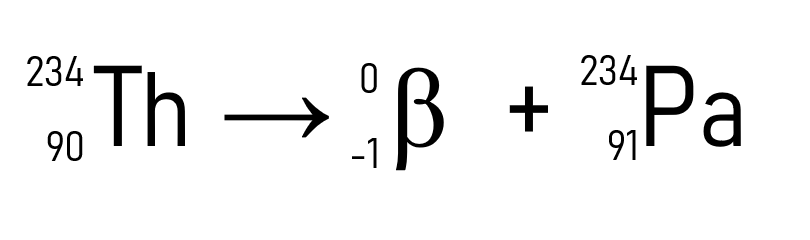
Além desse, um exemplo bem conhecido é o do decaimento do carbono-14, utilizado na datação de artefatos históricos:
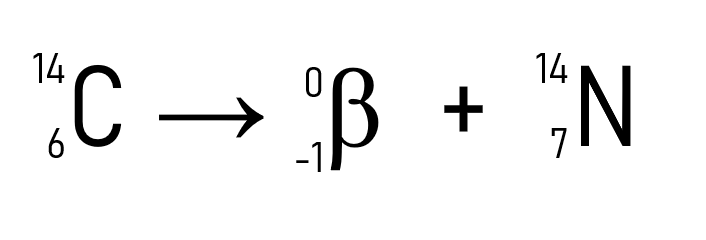
Com os exemplos e aplicações das leis da radioatividade fica claro que o fenômeno ocorre no núcleo dos átomos, provando que a alteração na quantidade de prótons ou nêutrons, ou seja, do número atômico, transforma um elemento radioativo em outro, até que uma estabilidade seja adquirida quando o Z for menor que 84.
Elementos radioativos
Existe duas categorias de elementos radioativos: os naturais e os artificiais. Os elementos radioativos naturais são aqueles encontrados na natureza já com seus núcleos atômicos instáveis, como é o caso do urânio ou o rádio. Por outro lado, os elementos radioativos artificiais não ocorrem naturalmente, sendo sintetizados em aceleradores de partículas, em processos que desestabilizam o núcleo dos átomos, com é o caso do astato ou do frâncio. Abaixo, alguns exemplos de elementos radioativos.
- Urânio (U): é o último elemento químico natural encontrado na tabela periódica. Encontrado na natureza na forma de óxido uranoso (UO2), é um dos elementos radioativos mais conhecidos e o responsável pela descoberta das emissões radioativas por Becquerel.
- Césio (Cs): é um elemento da família dos metais alcalinos terrosos. Apesar de raro na natureza, seu isótopo Cs-137 já foi utilizado em muitas máquinas de radioterapia. Inclusive é o elemento responsável pelo desastre nuclear ocorrido em Goiânia em 1987 que matou 4 pessoas e deixou 250 contaminados.
- Polônio (Po): um dos elementos descobertos pelo casal Curie, é o que possui maior intensidade de emissão radioativa entre todas as substâncias existentes.
- Rádio (Ra): em seus estudos de radioatividade, o rádio foi o primeiro elemento descoberto por Marie Curie. Ele apresenta a emissão de radiações gama que são utilizadas na esterilização industrial de alguns alimentos.
Aqui estão listados apenas alguns exemplos, pois como já comentado, todos os elementos que possuem número atômico maior que 85 sofrem algum tipo de decaimento radioativo, isso porque a quantidade de nêutrons no núcleo é incapaz de estabilizar todos os prótons presentes. Sendo assim, os elementos mais pesados tendem sempre a buscar estabilidade pelas emissões de radiação.
Para que serve a radioatividade?
Desde sua descoberta, a radioatividade tem sido empregada na sociedade, promovendo avanços tecnológicos e científicos. É empregada em diferentes áreas, desde a medicina até a arqueologia. Veja algumas aplicações a seguir:
Usinas nucleares
Uma maneira alternativa às hidrelétricas para a obtenção de energia é a de utilizar reações nucleares. Em um ambiente controlado, reações de fissão ou fusão nuclear são realizadas e o calor gerado desses processos é utilizado para o aquecimento e vaporização de grandes quantidades de água. O vapor formado movimenta turbinas geradoras de eletricidade, produzindo a energia que é distribuída pela rede elétrica. No Brasil, apesar do potencial hidrelétrico para produção de energia, também existe a usina nuclear de Angra dos Reis, no Rio de Janeiro.
Datação por C-14
Todo ser vivo possui, enquanto vivo, uma quantidade constante do isótopo do carbono, conhecido como C-14. Quando morre, a quantidade de C-14 desse ser começa a decair radioativamente, portanto, é possível estimar a data que o ser vivo morreu a partir da concentração de carbono-14 remanescente. É uma técnica empregada para determinação da idade de fósseis encontrados em sítios arqueológicos.
Medicina
Na medicina, a radioatividade esta presente nos aparelhos de raio-X, que bombardeiam os tecidos com a radiação que é capitada pelo equipamento e tem o objetivo de observar internamente o corpo humano. Além disso, é utilizada na radioterapia, para o tratamento de câncer, destruindo as células doentes com uma dosagem controlada de radiação.
Existem, ainda, diversas outras aplicações da radioatividade na sociedade. Um problema enfrentado é de lixo radioativo acumulado em locais como aterros sanitários, oriundos de descarte incorreto de materiais radioativos, por exemplo.
Vídeos sobre o fenômeno da radioatividade
Agora que o conteúdo já foi apresentado, veja alguns vídeos que ajudam a assimilar o tema estudado.
Revisão do conceito de radioatividade
A radioatividade é um fenômeno nuclear, ou seja, ocorre no núcleo dos átomos quando aqueles que são instáveis se transformam em átomos estáveis pela emissão de diferentes partículas, como as alfa, beta ou gama. Veja um apanhado geral sobre esse conteúdo muito cobrado nos diferentes exames e vestibulares do país.
Termos usados na química nuclear da radioatividade
Uma reação nuclear seria a mesma coisa que uma reação química? O que é um núcleo de átomo instável? Quais são as características das partículas radioativas? Tenha a resposta para essas perguntas com esse vídeo, além de uma representação do experimento realizado por Rutherford para a identificação das radiações emitidas pelos núcleos de alguns átomos.
Como visualizar a radioatividade
A todo momento somos bombardeados com uma parcela bem pequena de partículas radioativas vindas do espaço. Além disso, existem alguns materiais que são mais radioativos que outros. É possível observar a emissão da radiação de objetos com um experimento chamado de “câmara de nuvens”. Veja as partículas emitidas pelo Tório presente em uma barra de tungstênio nessa experiência muito interessante.
Em síntese, a radioatividade é um fenômeno nuclear em que átomos de núcleos instáveis emitem radiação ao tentar atingir a estabilidade. A emissão é feita na forma de partículas alfa ou beta e de onda eletromagnética (radiação gama). Não pare de estudar: saiba mais sobre a datação por carbono-14, feita pelo decaimento radioativo do C-14.
Referências
Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente (2005) – Peter Atkins e Loretta Jones
Química: a ciência central (1999) – Theodore L. Brown, Eugene H. LeMay, Bruce E. Bursten e Julia R. Burdge
Química Inorgânica(1992) – Peter Atkins, Duward F. Shriver e Cooper H. Langford

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Radioatividade. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/radioatividade. Acesso em: 31 de January de 2026.
1. [FGV-SP]
O uso do radioisótopo rutênio-106 (106Ru) vem sendo estudado por médicos da Universidade Federal de São Paulo no tratamento de câncer oftalmológico. Esse radioisótopo emite radiação que inibe o crescimento das células tumorais. O produto de decaimento radiativo do rutênio-106 é o ródio-106 (106Rh). (http://www.scielo.br/pdf/rb/v40n2/08.pdf. Adaptado)
A partícula emitida no decaimento do rutênio-106 é
a) Beta menos, β-.
b) Beta mais, β+.
c) Alfa, α.
d) Gama, γ.
e) Próton, p.
Olhando na tabela periódica, o rutênio tem Z = 44 e o ródio tem Z = 45. Como o produto do decaimento do 106Ru é um elemento novo com a mesma massa atômica, a partícula emitida foi uma partícula β-.
Assim, a alternativa correta é: a) Beta menos, β-.
2. [UESB]
A radioatividade emitida por determinadas amostras de substâncias provém
a) da energia térmica liberada em sua combustão.
b) de alterações em núcleos de átomos que as formam.
c) de rupturas de ligações químicas entre os átomos que as formam.
d) do escape de elétrons das eletrosferas de átomos que as formam.
e) da reorganização de átomos que ocorre em sua decomposição.
A radioatividade é um fenômeno nuclear resultante do rearranjo de núcleo de átomos instáveis que buscam a estabilidade.
Portanto, a alternativa correta é: b) de alterações em núcleos de átomos que as formam.