Os isótopos, isóbaros e isótonos são a classificação especificada dos átomos que compõem um elemento químico. Todo o elemento químico é composto por um conjunto de átomos cujo número atômico (Z) é igual.
Publicidade
Sendo assim, todos os formadores daquele elemento químico apresentarão a mesma quantidade de prótons no núcleo. Cada tipo de átomo, no entanto, possui um diferente número de prótons, fazendo disso novos elementos mutáveis.
Exemplo prático é pegar o primeiro elemento da tabela periódica, à esquerda, na parte de cima, no caso o hidrogênio. O Hidrogênio possui número atômico 1, por apresentar apenas um próton no núcleo. À direita temos o segundo elemento da tabela, o hélio, cujo número atômico será 2, por apresentar dois prótons no núcleo.
É importante ressaltar que o número de prótons representará o número atômico, e igualmente o número de elétrons. Isso, claro, se o elemento estiver eletricamente neutro
Isótopos, isóbaros e isótonos: diferenças
Quando se analisa o número atômico, a quantidade de nêutrons e a respectiva massa dos diversos átomos, é possível separá-los. Essa classificação englobará elementos e comum, a partir dos conceitos que cernem os isótopos, isóbaros e isótonos.
Isótopos: prótons iguais e massas diferentes
Os isótopos apresentam como característica o mesmo número de prótons (ou seja, igual número atômico), mas diferente número de massa. Dessa maneira, também apresentará um número diferente dos nêutrons.
Vale adendo de que os isótopos podem ser átomos de diferentes elementos químicos, denominando-se nuclídeos.
Publicidade
A isotopia é um fenômeno de ocorrência de isótopos. Muito comum na natureza, é importante ressaltar que um número expressivo de elementos químicos naturais são formados por mistura de isótopos.
As propriedades químicas dos isótopos, portanto, serão iguais. Essa similaridade estará relacionada à estrutura observada na eletrosfera.
As propriedades físicas, entretanto, serão diferentes. Afinal, estas estarão influenciadas diretamente pelo número de massa, que nos isótopos é diferente.
Publicidade
O exemplo de diferentes isótopos está no hidrogênio. Estes serão os únicos que apresentarão nominações diferentes para cada isótopo: o hidrogênio, deutério e trítio.
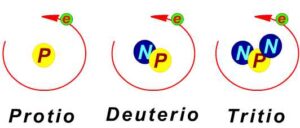
Isóbaros: prótons diferentes e massas iguais
Os isóbaros terão números de próton diferentes, mas com os números de massa iguais. Dessa forma, terão propriedades químicas e físicas diferentes.
Outro detalhe está para o maior número de prótons compensando pelo maior número de neutros. Por meio, podem ser elucidados a partir do seguinte exemplo:

Isótonos: massa e prótons diferentes
Ao fim da classificação em isótopos, isóbaros e isótonos, temos os últimos citado, os isótonos. Estes átomos não só terão o número de prótons diferentes, como também o de massa.
Diferentemente dos demais, o número de nêutrons serão iguais. Assim, serão elementos diferentes que contarão com propriedades físicas e químicas diferentes.

Referências
SALVADOR, Edgard e USBERCO, João. Química, volume único. 1ª edição, Editora Saraiva, São Paulo-SP, 2006. 672 p.

Por Mateus Bunde
Graduado em Jornalismo pela Universidade Federal de Pelotas (UFPel), Especialista em Linguagens pelo Instituto Federal Sul-Rio-Grandense (IFSul) e Mestrando em Comunicação pela Universidade do Porto, de Portugal (UP/PT).
Bunde, Mateus. Isótopos, isóbaros e isótonos. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/isotopos-isobaros-e-isotonos. Acesso em: 07 de March de 2026.
01. [UFPA] Os isótopos do hidrogênio recebem os nomes de prótio (1H1), deutério (1H2) e trítio (1H3). Nesses átomos os números de nêutrons são, respectivamente, iguais a:
a) 0, 1 e 2.
b) 1, 1 e 1.
c) 1, 1 e 2.
d) 1, 2 e 3.
e) 2, 3 e 4.
02. [UA-AM] Em relação à isotopia, isobaria e isotonia, podemos afirmar que:
a) isótonos são entidades químicas que possuem o mesmo número de nêutrons.
b) isóbaros são entidades químicas que possuem o mesmo número de prótons.
c) isótopos são entidades químicas que possuem o mesmo número de massa.
d) são relações que dizem respeito ao núcleo e à eletrosfera do átomo.
e) são relações que dizem respeito apenas à eletrosfera do átomo.
01. [A]
02. [A]