Um átomo é a menor partícula que é capaz de identificar um elemento químico e participar de uma reação química. Trata-se de uma partícula fundamental da matéria, que recebeu esse nome do filósofo grego Demócrito. Este acreditava que os materiais apresentavam, em sua totalidade, partes muito pequenas, que não poderiam mais ser divididas, e daí o nome átomo: a – não, tomos – divisões. 23 séculos depois da morte do filósofo, John Dalton, cientista inglês, retomou as ideias e, a partir de experimentos, conseguiu concluir três coisas: Toda matéria é realmente formada por partículas diminutas e indivisíveis, que são os átomos; Existe um número finito de átomos na natureza; e a combinação entre átomos, iguais ou diferentes, é o que origina os materiais.
Publicidade
Ele propôs um modelo atômico, no ano de 1897, que ficou conhecido como “pudim de passas”, determinando que haviam, de forma simultânea, cargas positivas e negativas. Mas foi a partir da descoberta da radioatividade que passou a ser possível definir que as partículas contavam com os prótons, que tem carga positiva, e que estas se concentravam na região central do átomo, denominada núcleo, e que os elétrons, de carga negativa, ficavam circundando esse núcleo. Isso passou a ser questionado quando pesquisadores começaram a discutir a respeito do equilíbrio. Se as cargas iguais se repelem, como seria possível o equilíbrio dessas partículas?
Rutherford explicou o fato com seu modelo atômico que recebeu o seu nome. Ele sugeriu que existiam partículas entre os prótons que eliminariam essa repulsão, e no ano de 1932, James Chadwick descobriu que no núcleo haviam partículas sem carga, que ficaram conhecidos como nêutrons. O modelo de Rutherford era bastante parecido com o sistema solar, tendo o sol como núcleo e os planetas como elétrons. Niels Bohr ampliou esse modelo, e propôs que os elétrons ficariam girando em torno do núcleo, mas em camadas, e quanto mais perto do núcleo, menor seria a energia. Os elétrons, ao receberem energia, poderiam, portanto, saltar para camadas mais distantes do núcleo.
Partículas subatômicas
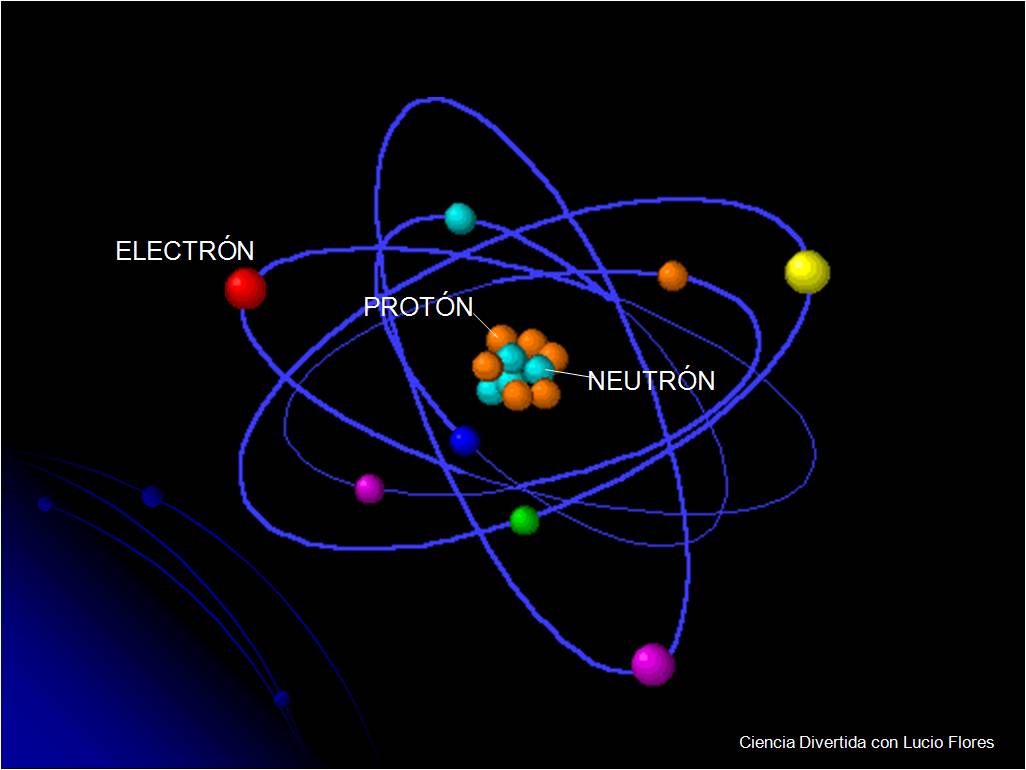
Ao que sabemos nos dias atuais, os átomos são formados pelo que chamamos de partículas subatômicas, que nada mais são do que os prótons, nêutrons, elétrons, pósitrons, quarks, neutrinos e mésons. Entretanto, as subpartículas fundamentais são as que nos interessam agora, que são os prótons, nêutrons e elétrons.
Os prótons e elétrons são eletricamente carregados, enquanto os nêutrons, como o nome mesmo faz referência a “neutro”, não apresenta carga. Prótons e nêutrons possuem aproximadamente a mesma massa, enquanto os elétrons apresentam uma massa em torno de 2 mil vezes menor do que a de um próton.
Os elétrons são partículas dotadas de carga elétrica negativa, -1,6.10-19C, movem-se de forma bastante rápida em torno do núcleo atômico, o que gera campos eletromagnéticos. Os prótons, junto aos nêutrons, formam o núcleo atômico. Apresentam carga positiva que possui o mesmo valor absoluto que a carga dos elétrons de forma que estes apresentam tendência a se atraírem eletricamente. Por fim, os nêutrons representam 99,9% da massa do átomo, e possuem, como já foi dito, carga elétrica nula, resultante das subpartículas que os compõe, sendo dispostos de forma estratégica no núcleo, objetivando estabilizar, já que a adição de um nêutron a dois prótons que se repelem de forma mútua causa instabilidade elétrica rompendo o átomo (princípio da fissão nuclear).
Os elétrons estão dispostos em 8 camadas, constituindo a eletrosfera. Os subníveis de cada camada são preenchidos, e a camada mais distante do núcleo é chamada de camada de valência, sendo esta a mais energética dentre todas.
Publicidade
Número de massa e número atômico
Chamamos de número atômico, representado pela letra Z, a quantidade de prótons que existem no núcleo do átomo. Essas informações são disponibilizadas na tabela periódica, em cima do elemento. Na representação dos elementos químicos, o número de massa (A) aparece na parte superior, enquanto o número atômico vem na parte inferior. 11Na23, nesse exemplo, temos que o número de massa é igual a 23, enquanto o número atômico é 11.
O número de massa, por sua vez, é a soma do número atômico, ou número de prótons, com o número de nêutrons. Confira o exemplo abaixo:
“O elemento sódio possui 11 prótons e 12 nêutrons, qual é o seu número de massa?”
A = p + n
A = 11 + 12
A = 23
Com essa fórmula, também conseguimos descobrir o número de nêutrons: “Um átomo de ferro (Z=26) possui um número de massa igual a 56, Quantos nêutrons existem em seu núcleo?”
N = A – Z
N = 56 – 26
N = 30
Publicidade
Referências
Química para o ensino médio – EF Mortimer, AH Machado

Por Natália Petrin
Formada em Publicidade e Propaganda. Atualmente advogada com pós-graduação em Lei Geral de Proteção de Dados e Direito Processual Penal. Mestranda em Criminologia.
Petrin, Natália. Átomo. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/atomo. Acesso em: 04 de February de 2026.
01. [FUVEST] O átomo constituído de 17 prótons, 18 nêutrons e 17 elétrons, possui número atômico e número de massa igual a:
a) 17 e 17
b) 17 e 18
c) 18 e 17
d) 17 e 35
e) 35 e 17
02. [FUVEST] A seguinte representação , X = símbolo do elemento químico, refere-se a átomos com:
a) Igual número de nêutrons;
b) Igual número de prótons;
c) Diferentes números de elétrons;
d) Diferentes números de atômicos;
e) Diferentes números de oxidação;
01. [D]
02. [B]