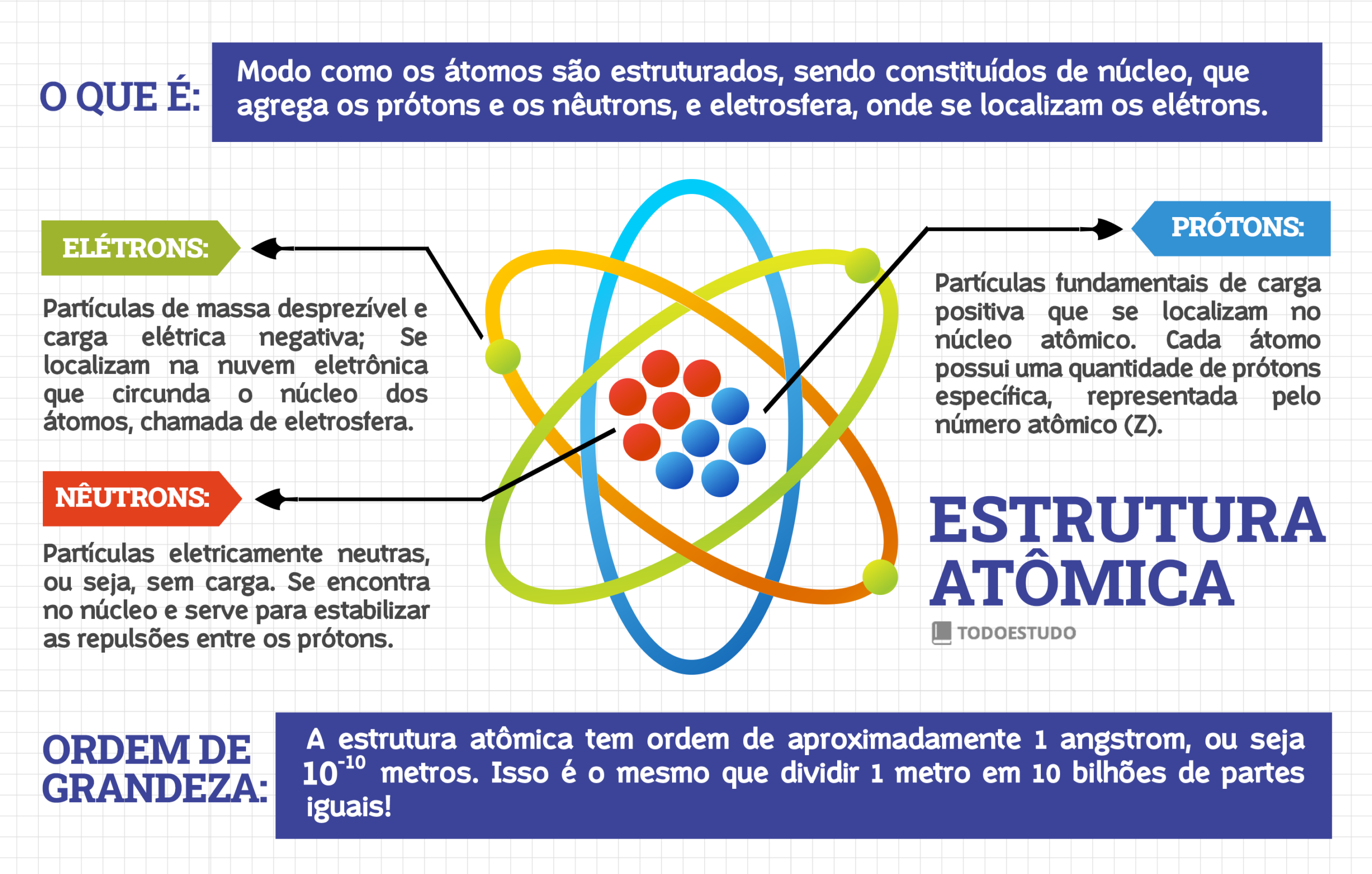
A estrutura atômica é a maneira com que os átomos são organizados. Eles são divididos em duas partes principais, núcleo e eletrosfera, que comportam as partículas elementais, os prótons, nêutrons e elétrons. Aprenda sobre a estrutura atômica e as principais características de cada uma dessas partículas atômicas.
Publicidade
Como é a estrutura atômica atual
A estrutura dos átomos é constituída de três partículas fundamentais. Os prótons e os nêutrons, que se localizam no núcleo atômico e definem a massa atômica. E o elétron, terceira partícula fundamental que se localiza na eletrosfera e fica orbitando o núcleo. Entenda mais sobre cada uma dessas partículas.
Relacionadas
Prótons
Os prótons são as partículas de carga positiva (+1) que se localizam no núcleo atômico. Cada átomo tem uma quantidade específica de prótons, portanto, seu valor é o que caracteriza um elemento químico. De fato, essa característica é chamada número atômico sendo representada pela letra Z. Por convenção, o valor de massa relativa dos prótons é dado como 1 unidade de massa atômica (1 u).
Nêutrons
Também localizados no núcleo, o nêutrons são as partículas de carga nula. Eles existem para estabilizar as repulsões existentes entre os prótons, fazendo com que os átomos possam existir em seus estados fundamentais. Sua massa relativa também é igual a 1 u, portanto a soma de prótons e nêutrons é igual ao número de massa dos átomos, representados por A e a equação é A = Z + n.
Elétrons
Os elétrons são as partículas de carga negativa (-1) localizados ao redor do núcleo, numa região chamada de eletrosfera. A quantidade de elétrons de um átomo no estado fundamental é idêntica à quantidade de prótons, visto que uma carga negativa anula uma carga positiva. A massa do elétron é considerada desprezível, porque ele é muito mais leve que os prótons e nêutrons (cerca de 1840 vezes mais leve), sem ter influência na massa.
Essa são as partículas fundamentais que fazem parte da estrutura atômica. Cada elemento é único e apresenta uma quantidade específica de prótons nêutrons e elétrons. A única exceção é o átomo de hidrogênio, que não possui nêutrons. Ele é constituído de um próton e um elétron, apenas.
Publicidade
Como é feita a análise da estrutura atômica
A análise da estrutura atômica pode ser feita avaliando sua massa. Existem equipamentos que ionizam átomos pela remoção de um elétron e passagem desse átomo ionizado por um campo magnético, de modo que o raio da trajetória é determinado pela massa atômica. Sendo assim é possível prever a quantidade de prótons, nêutrons e elétrons do átomo em estudo.
Qual é a ordem de grandeza da estrutura atômica?
Os átomos são extremamente pequenos. Sua ordem de grandeza está na casa do angstrom (Å), uma unidade de medida equivalente a 1×10-10 m, ou seja, 1 Å é igual a 0,0000000001 metros. É o mesmo que pegar 1 metro e dividir em 10 bilhões de partes iguais.
A estrutura atômica e a classificação periódica
Como cada átomo é único e sua estrutura atômica é o que garante suas características, eles puderam ser organizados na tabela periódica conhecida hoje em dia. Nela, os elementos aparecem em ordem crescente de número atômico, ou seja, de quantidade de prótons. Isso significa que a cada elemento é adicionado um próton, comparado ao anterior. Consequentemente, a quantidade de nêutrons e elétrons também aumenta.
Publicidade
Mapa mental
Para simplificar as informações e te ajudar no entendimento do tema, veja abaixo um mapa mental sobre a estrutura atômica:
Consulte o mapa mental sempre que sentir necessidade, seja para tirar dúvida ou na hora de fazer uma revisão. Dessa forma, fica fácil lembrar as principais informações sobre as partes que compõem os átomos.
Vídeos sobre a estrutura atômica
Agora que o conteúdo já foi apresentado, veja alguns vídeos selecionados que te ajudarão a assimilar o tema do estudo.
Os átomos e sua estrutura
Os átomos são estruturados em núcleo e eletrosfera. Veja quais são as partículas fundamentais dos átomos. Entenda como elas devem ser representadas e como realizar os cálculos sobre todas as informações que os átomos podem fornecer para o estudo da estrutura atômica.
Informações obtidas pela estrutura atômica
Os átomos são constituídos de um núcleo que contem os prótons e os nêutrons, e uma eletrosfera, onde estão os elétrons. Veja como é a estrutura atômica e quais são as informações que é possível obter com ela sobre um elemento químico.
As partículas fundamentais dos átomos
As partículas fundamentais de um átomo são os prótons, nêutrons e elétrons. Veja como eles estão organizados no átomo e, além disso, entenda sobre os experimentos realizados para determinar características dessas partículas que compõem a estrutura dos átomos.
Em síntese, os átomos são organizados em duas regiões, o núcleo e a eletrosfera. No núcleo se localizam os prótons e os nêutrons, enquanto os elétrons orbitam o núcleo na região da eletrosfera. Não pare de estudar aqui, veja sobre um fenômeno nuclear, a radioatividade.
Referências
Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente (2005) – Peter Atkins e Loretta Jones
Química: a ciência central (1999) – Theodore L. Brown, Eugene H. LeMay, Bruce E. Bursten e Julia R. Burdge
Química Inorgânica (1992) – Peter Atkins, Duward F. Shriver e Cooper H. Langford

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Estrutura atômica. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/estrutura-atomica. Acesso em: 27 de February de 2026.
1. [UFU-MG]
O átomo é a menor partícula que identifica um elemento químico. Ele possui duas partes, a saber: uma delas é o núcleo, constituído por prótons e nêutrons, e a outra é a região externa – a eletrosfera-, por onde circulam os elétrons. Alguns experimentos permitiram a descoberta das características das partículas constituintes do átomo.
Em relação a essas características, indique a alternativa correta.
a) prótons e elétrons possuem massas iguais e cargas elétricas de sinais opostos.
b) entre as partículas atômicas, os elétrons têm maior massa e ocupam maior volume no átomo.
c) entre as partículas atômicas, os prótons e os nêutrons têm maior massa e ocupam maior volume no átomo.
d) entre as partículas atômicas, os prótons e os nêutrons têm mais massa, mas ocupam um volume muito pequeno em relação ao volume total do átomo.
A alternativa correta é a letra d) entre as partículas atômicas, os prótons e os nêutrons têm mais massa, mas ocupam um volume muito pequeno em relação ao volume total do átomo. Pois, são as partículas que definem a massa dos elementos químicos.
Analisando as demais alternativas:
a) ERRADA. A massa dos elétrons é cerca de 1800 vezes menor que a dos prótons.
b) ERRADA. Os elétrons possuem massa desprezível, mas ocupam o maior volume.
c) ERRADA. O maior volume é ocupado pelos elétrons, na eletrosfera.
2. [PUC-MG]
O íon óxido O2- possui o mesmo número de elétrons que:
Dados: O (Z=8); F (Z=9); Na (Z=11); Ca (Z=20); S (Z=16);
a) o íon fluoreto F–.
b) o átomo de sódio Na.
c) o íon cálcio Ca2+.
d) o íon sulfeto S2-.
O número de prótons é igual ao número de elétrons de um átomo neutro. O O2- tem um excesso de duas cargas negativas, dois elétrons a mais. Como o oxigênio tem Z = 8, o O2- tem 8+2 elétrons, ou seja, 10 elétrons.
Analisando e fazendo o mesmo para as alternativas
a) o íon fluoreto F– → 9 + 1 = 10 elétrons.
b) o átomo de sódio Na → 11 elétrons.
c) o íon cálcio Ca2+ → deficiência de dois elétrons, 20 – 2 = 18 elétrons.
d) o íon sulfeto S2- → 16 + 2 = 18 elétrons.
Sendo assim, a alternativa correta é a letra a) o íon fluoreto F–.