O butano é um hidrocarboneto de fórmula molecular C4H10 obtido da destilação do petróleo. Em temperatura ambiente é um gás inflamável e é o principal combustível presente no gás de cozinha. Por ser derivado de petróleo, é uma fonte não-renovável de energia. A seguir, aprenda mais sobre esse composto e veja suas principais características.
Publicidade
O que é o butano
Também chamado de n-butano, esse composto é um hidrocarboneto saturado, ou seja, que não possui ligações duplas ou triplas, da família dos alcanos. Sua fórmula molecular é C4H10. É um gás incolor e altamente inflamável. Foi descoberto em 1849 pelo químico britânico Edward Frankland, porém suas propriedades só foram descritas após ele ter sido encontrado dissolvido em petróleo, em 1864 pelo químico inglês Edmund Ronalds.
Relacionadas
Como dito, o butano é encontrado no petróleo, portanto sua obtenção é feita pela destilação fracionada desse composto. Assim como todos os derivados dessa fonte, o butano é uma forma de energia não-renovável. Com relação a sua toxicidade, a inalação desse gás causa euforia, sonolência, perda de consciência, arritmia cardíaca e a morte por asfixia.
Composição do butano
O butano é composto de quatro átomos de carbono e dez de hidrogênio, ou seja, sua fórmula é C4H10. Seu nome segue a regra dos hidrocarbonetos, indicando a quantidade de carbonos (BUT- para quatro C), os tipos de ligações entre os átomos (-AN- para ligações simples) e, finalmente, a terminação de hidrocarbonetos (-O). É uma molécula apolar e insolúvel em água.
A seguir, veja algumas das principais propriedades e características físico-químicas desse composto orgânico da classe dos hidrocarbonetos.
Propriedades
- Sua massa molar é de 58,124 g/mol;
- É sólido em temperaturas menores que -140 °C;
- Seu ponto de ebulição é entre -1 e 1 °C, portanto ele é gasoso em temperatura ambiente;
- Com ρbutano = 2,48 kg/m3, o butano é um gás mais denso que o ar atmosférico, visto que ρar = 1,2 kg/m3;
- Quando comprimido sob pressão, se torna líquido pelo efeito da liquefação;
- Na presença de oxigênio em abundância, sofre combustão completa. Os produtos dessa queima são CO2 e água.
Essas são algumas das características desse gás. Entretanto, a mais importante é a de sua inflamabilidade, ou seja, capacidade de ser inflamável. Essa propriedade do butano permite que ele seja usado no gás de cozinha, como o combustível da chama dos fogões.
Publicidade
Funções do butano
Agora, veja as principais funções e aplicações desse composto, tanto no cotidiano quanto em escala industrial:
- Constituinte do gás de cozinha: o butano está presente no gás liquefeito do petróleo (GLP), com uma mistura de outros hidrocarbonetos, incluindo o propano (todos inodoros) e o etanodiol, tem cheiro forte e ajuda na percepção de vazamentos;
- Propelente de aerossóis: alguns desodorantes usam o butano como gás propelente, que proporciona a formação do aerossol;
- Matéria-prima na produção de borracha sintética: o butano é o precursor da produção de etileno e butadieno, ambos essenciais para a fabricação de borracha sintética;
- Solvente de extração de fragrâncias: alguns hidrocarbonetos aromáticos podem ser extraídos com butano liquefeito (sob pressão). O fato do solvente ser gasoso em temperatura ambiente, faz com que ele evapore facilmente do extrato sem o uso de aquecimento, que pode degradar os compostos extraídos.
Como ressaltado, a principal aplicação do butano é como combustível de queima, fornecendo energia térmica. Isso proporciona o uso em cozinhas, fogareiros portáteis e até mesmo como fonte de aquecimento de sistemas de calefação.
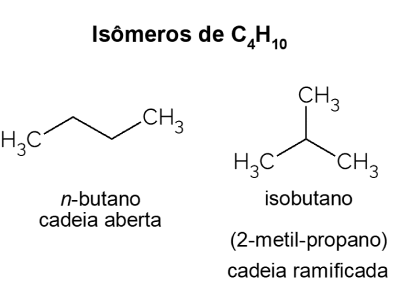
Butano X isobutano
O butano apresenta isômeros, ou seja, compostos que apresentam a mesma fórmula molecular (C4H10), porém com estruturas diferentes. Para haver distinção, o hidrocarboneto de cadeia aberta é chamado de n-butano e seu isômero de cadeia ramificada é o isobutano, cujo nome oficial é “2-metil-propano”. Ele possui características semelhantes ao n-butano, porém é mais usado para a síntese de isooctano, um aditivo da gasolina.
Publicidade
Vídeos sobre o butano
Abaixo, acompanhe os vídeos selecionados que vão te ajudar a assimilar o tema estudado:
Experiencia e resolução de exercício sobre o C4H10
O butano está presente em algumas embalagens de desodorantes como o gás propelente. Nessa experiência, veja a inflamabilidade desse composto e sua reação de combustão. Além disso, confira a resolução de um exercício cobrado no ENEM sobre uma reação de queima completa do composto.
Exercício resolvido sobre massa molar de compostos orgânicos
Uma dúvida muito comum em química é relacionada a determinação da massa de um composto partindo de sua massa molar, ou seja, a quantidade que 1 mol de substância pesa. Veja um exemplo para determinar a massa de qualquer quantidade de matéria dos compostos, tendo como ponto de partida sua massa molar.
A densidade do butano
Esse gás também está presente em alguns isqueiros, como combustível. Veja nessa experiência duas propriedades dele, sua densidade e inflamabilidade. Como sua densidade é quase duas vezes maior que a densidade do ar atmosférico, no momento da coleta, o butano se concentra no fundo do recipiente. Esse fato é confirmado pela queima ao entrar em contato com o fósforo aceso.
Em síntese, o butano é um composto da classe dos hidrocarbonetos. É um alcano saturado, apolar e constituído de 4 átomos de carbono e 10 de hidrogênio e é um dos principais componentes do gás de cozinha. Não pare de estudar por aqui, veja também sobre a nomenclatura de funções orgânicas.
Referências
Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente (2005) – Peter Atkins e Loretta Jones
Química: a ciência central (1999) – Theodore L. Brown, Eugene H. LeMay, Bruce E. Bursten e Julia R. Burdge
Química Orgânica (1976) – T. W. Graham Solomons
Química Orgânica – Volume 1 (1987) – Paula Yurkanis Bruice

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Butano. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/butano. Acesso em: 09 de February de 2026.
1. [FATEC-2008]
O gás liquefeito de petróleo, GLP, é uma mistura de propano, C3H8, e butano, C4H10. Logo, esse gás é uma mistura de hidrocarbonetos da classe dos:
a) alcanos.
b) alcenos.
c) alcinos.
d) cicloalcanos.
e) cicloalcenos.
Ambos são compostos da classe dos alcanos, pois as ligações entre os átomos são todas simples, alternativa a.
2. [ENEM - adaptada]
No Japão, um movimento nacional para a promoção da luta contra o aquecimento global leva o slogan: 1 pessoa, 1 dia, 1 kg de CO2 a menos! A ideia é cada pessoa reduzir em 1 kg a quantidade de CO2 emitida todo dia, por meio de pequenos gestos ecológicos, como diminuir a queima de gás de cozinha.
Um hambúrguer ecológico? É pra já! Disponível em: http://lqes.iqm.unicamp.br. Acesso em: 24 fev. 2012 (adaptado).
Considerando um processo de combustão completa de um gás de cozinha composto exclusivamente por butano (C4H10), a mínima quantidade desse gás que as pessoas devem deixar de queimar para atender à meta diária, apenas com esse gesto, é de
Dados: CO2 (44 g/mol); C4H10 (58 g/mol)
a) 0,25 kg.
b) 0,33 kg.
c) 1,0 kg.
d) 1,3 kg.
e) 3,0 kg.
A reação de combustão é:
C4H10 + 13/2 O2 → 4 CO2 + 5 H2O
A resolução é feita por regra de três, onde:
58 g de C4H10 = 44 g de CO2 * 4 mol produzidos
X kg C4H10 = 1 kg de CO2
58g = (44 * 4) g
x 1 kg
58 = 176
x 1
x = 58
176
x = 0,329 kg
Portanto, a alternativa correta é a letra b) 0,33 kg.