Um anel aromático é uma estrutura cíclica de ligações duplas alternadas entre carbonos. O composto aromático mais simples é o benzeno, de fórmula C6H6. Existem anéis aromáticos com mais de seis átomos ou até mesmo com heteroátomos, ou seja, átomos diferentes do carbono. Saiba mais sobre essa estrutura química e suas características.
Publicidade
O que é o anel aromático
Um anel aromático é uma estrutura química cíclica, formada pela alternância de ligações duplas. Esse fato faz com que as estruturas apresentem o fenômeno de ressonância, visto que os elétrons π responsáveis pelas ligações duplas formam uma nuvem eletrônica deslocalizada. Além disso, a ressonância garante que a estrutura do anel aromático seja mais estável que um correspondente com o mesmo número de átomos na estrutura cíclica.
Relacionadas
Anéis aromáticos podem ter mais de 6 átomos na estrutura, porém para que sejam caracterizados dessa forma, precisam obedecer à regra de Hückel, representada pela equação:
4n + 2 = quantidade de elétrons π
Ao contar a quantidade de elétrons π (cada ligação dupla indica a presença de um par de e–) existentes na molécula e resolver a equação, n deve ser um número inteiro para que o composto seja classificado como aromático. Caso contrario, se o número obtido for decimal, a molécula não é aromática. Veja um exemplo.
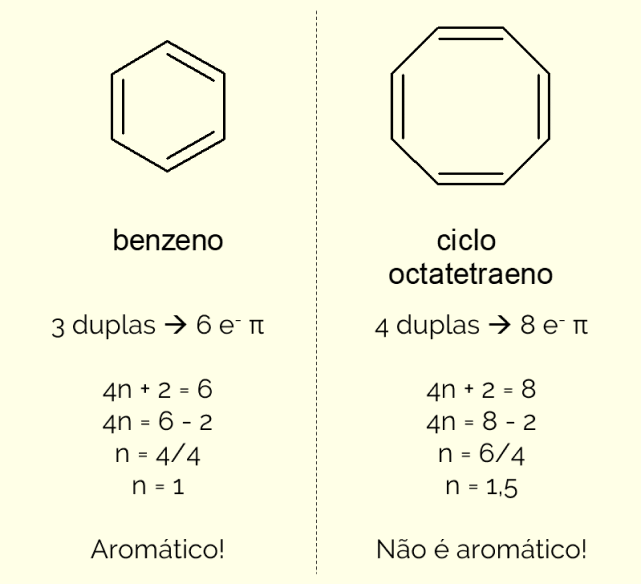
Além disso, um anel aromático pode ser classificado de duas formas: homocíclico ou heterocíclico. O primeiro caso diz respeito às estruturas constituídas apenas de átomos de carbono e hidrogênio. Por outro lado, os heterocíclicos são compostos formados pela presença de um ou mais heteroátomo no próprio anel, ou seja, átomos diferentes de carbono e hidrogênio, como oxigênio, nitrogênio ou enxofre.
Publicidade
Características
Os compostos cíclicos aromáticos possuem algumas características, tanto ao nível molecular e estrutural, quanto em relação às propriedades físico-químicas das substâncias. Veja algumas dessas características dos anéis aromáticos.
- Estruturalmente falando, devem obedecer à regra de Hückel para aromaticidade de anéis;
- Ainda ao nível estrutural, o anel aromático é uma estrutura plana, com ligações duplas alternadas;
- Apresentam pontos de ebulição mais altos que os hidrocarbonetos de cadeia aberta com mesmo número de carbono, visto que são compostos estabilizados pela ressonância;
- São moléculas apolares;
- Não são solúveis em água;
- Quando queimados, liberam fuligem;
Sendo assim, os hidrocarbonetos aromáticos são, majoritariamente, não polares e imiscíveis em água. São usados como solventes para compostos apolares e a razão de carbono e hidrogênio é alta, portanto soltam uma fuligem escura quando queimados.
Nomenclatura do anel aromático
Como o anel aromático mais comum é o benzeno, existe um tipo de nomenclatura específica para os casos que há ramificações no anel, principalmente quando ele for dissubstituído, ou seja, quando houver duas substituições. Devido à simetria do benzeno, as substituições podem acontecer de três formas. Se ocorre nos carbonos 1,2 o prefixo “ORTO” é adicionado antes do nome da molécula. Caso seja nos carbonos 1,3 é adicionado “META”. Por fim, se for nos carbonos 1,4, deve-se adicionar o termo “PARA”. Veja os exemplos a seguir.
Publicidade
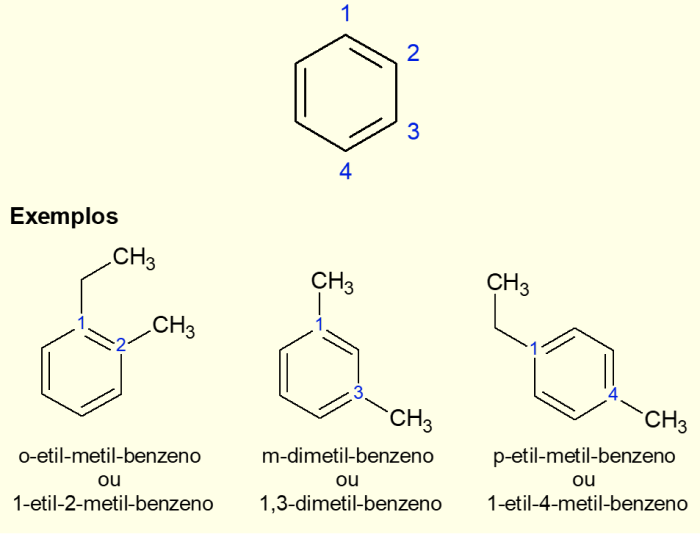
Exemplos
Veja, agora, alguns compostos que são constituídos de anéis aromáticos na estrutura e suas principais aplicações.
- Benzeno: é o principal e mais simples anel aromático estudado em química orgânica. É um líquido inflamável e incolor, de aroma adocicado, porém tóxico e carcinogênico. Usado como solvente e reagente precursor de diversos compostos orgânicos aromáticos;
- Tolueno: também chamado de metil-benzeno, é um líquido incolor e viscoso, de odor forte. É usado principalmente como solvente para pinturas e como cola para borrachas, motivo pelo qual é popularmente chamado de “cola de sapateiro”;
- Fenol: o hidroxibenzeno é uma substância sólida cristalina, muito tóxica para a saúde humana. É usado principalmente como precursor de outros compostos, como polímeros e resinas. Além disso, esta presente em alguns tipos de desinfetantes;
- Trinitrotolueno: popularmente chamado de TNT, é um composto extremamente explosivo, portanto, é usado na fabricação de bombas, visto que é relativamente estável e só explode com o auxílio de detonadores.
- Naftaleno: é constituído pela fusão de dois anéis aromáticos e popularmente chamado de “naftalina”. É um sólido branco que sofre sublimação à temperatura ambiente, ou seja, passa diretamente para o estado gasoso. Usado como agente anti-traça e baratas.
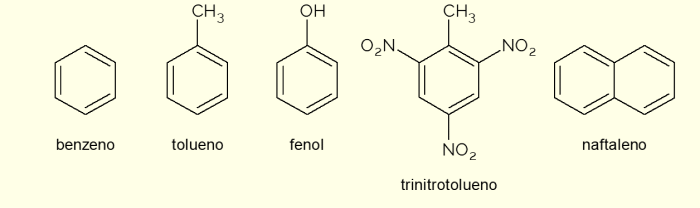
Esses são alguns exemplos dos compostos formados por anéis aromáticos. Porém, existem outros, formados de mais átomos no anel ou com átomos diferentes de carbono e hidrogênio.
Vídeos sobre os compostos aromáticos
Agora que o conteúdo já foi apresentado, veja alguns vídeos selecionados para ajudar a assimilar o tema:
A história dos compostos aromáticos
Os compostos que são formados por anéis aromáticos foram denominados dessa forma, pois a maioria das substâncias possui odores característicos. Além disso, o mais simples e principal composto aromático é o benzeno, identificado primeiramente por Michael Faraday, mas caracterizado por Kekulé algum tempo depois. Saiba mais sobre a história dessa classe de compostos tão importante para a química orgânica.
Nomenclatura em um anel aromático
Anéis aromáticos dissubstituídos possuem uma nomenclatura especial, dada pelo local das substituições no anel. Podem ser anéis orto, meta ou para. Saiba mais sobre como fazer essa nomenclatura e veja exemplos para saber exatamente quando usar cada um dos nomes, lembrando sempre das posições em que os substituintes estão localizados.
Condições para um composto ser aromático
Para que um composto cíclico seja aromático ele precisa seguir a regra de Hückel. Ela considera a quantidade de elétrons π presentes na molécula e correlaciona esse valor com a equação dos 4n + 2 elétrons π. Sendo assim, aprenda como calcular e determinar se um composto cíclico é, ou não, aromático.
Em síntese, o anel aromático é uma estrutura presente em compostos cíclicos e com ligações duplas alternadas. É estável pelo fenômeno de ressonância provocado pelos elétrons π das ligações duplas. Não pare de estudar por aqui, veja mais sobre os alcinos, outra classe de compostos insaturados em química orgânica.
Referências
Química Orgânica (1976) – T. W. Graham Solomons
Química Orgânica – Volume 1 (1987) – Paula Yurkanis Bruice
Química: a ciência central (1999) – Theodore L. Brown, Eugene H. LeMay, Bruce E. Bursten e Julia R. Burdge

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Anel aromático. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/anel-aromatico. Acesso em: 17 de February de 2026.
1. [UFSCar-SP]
A queima do eucalipto para produzir carvão pode liberar substâncias irritantes e cancerígenas, tais como benzoantracenos, benzofluorantenos e dibenzoantracenos, que apresentam em suas estruturas anéis de benzeno condensados. O antraceno apresenta três anéis e tem fórmula molecular:
a) C14H8
b) C14H10
c) C14H12
d) C18H12
e) C18H14
Para responder essa questão é mais fácil representar a estrutura do antraceno e contar a quantidade de carbonos e hidrogênios que ele possui. Sendo assim:
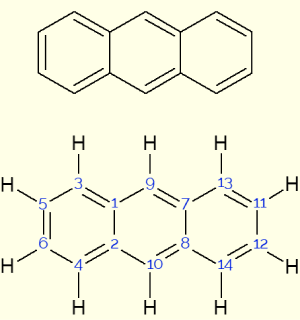
Portanto, a alternativa correta é a letra b) C14H10.
2. [UFOP-MG (adaptada)]
Considere a série de compostos aromáticos indicados de I a VI.
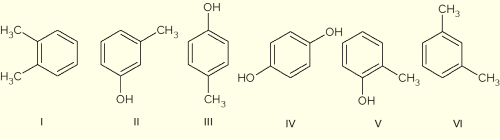
São nomeadas, utilizando o prefixo meta e para, respectivamente, as substâncias do par:
a) I e IV.
b) III e II
c) III e V.
d) II e IV.
e) VI e II.
Denominando cada orientação das substâncias citadas na questão, tem-se que:
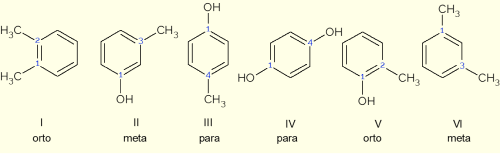
Sendo assim, aquela que apresenta o prefixo meta e para, em ordem, é a alternativa d) II e IV, pois:
a) I e IV – orto e para.
b) III e II – para e meta.
c) III e V – para e orto.
d) II e IV – meta e para.
e) VI e II – meta e meta.