Em química orgânica, o oxigênio é o terceiro elemento mais comum, depois do Carbono e do Hidrogênio. As funções orgânicas que são constituídas de oxigênio são chamadas de funções oxigenadas. Elas podem ser divididas em Álcoois, Aldeídos, Cetonas, Ésteres, Éteres, Ácidos Carboxílicos e Fenóis. A seguir, veremos como é caracterizado cada uma dessas funções.
Publicidade
Álcoois
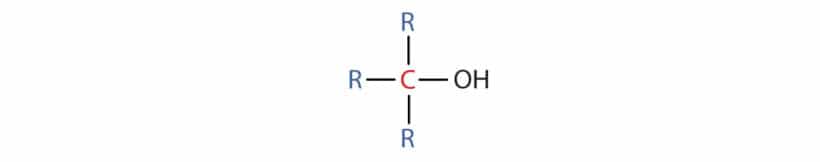
Os álcoois possuem em sua estrutura molecular um ou mais grupos hidroxila (-OH) ligados aos átomos de carbono saturado, isto é, que realiza somente ligações simples.
Relacionadas
O exemplo mais comum de compostos pertencentes a essa função é o álcool etílico, utilizado como combustível, solvente em reações químicas, limpeza e esterilização, além de ser o principal componente de bebidas alcoólicas. Nessa classe de compostos, ainda se encontra os colesteróis e os carboidratos.
Os álcoois são divididos de acordo com a quantidade de hidroxilas, ou grupos álcoois, presentes na molécula. Um grupo álcool caracteriza um monoálcool. Quando há duas hidroxilas é chamado de diálcool. Três ou mais é denominado poliálcool.
Os monoálcoois podem ser classificados ainda de acordo com o tipo carbono ao qual a hidroxila encontra-se ligada, isto é, se esse carbono é primário, secundário ou terciário.
Nomenclatura
De acordo com a União Internacional de Química Pura e Aplicada (IUPAC), os álcoois são nomeados de maneira similar aos hidrocarbonetos, substituindo o sufixo -o por -ol. Deve-se começar a contagem dos carbonos partindo da extremidade da cadeia mais próxima ao grupo -OH e também indicar, de acordo com o número do carbono, a posição do grupo álcool presente. No caso dos di ou poliálcoois, nomeia-se a cadeia carbônica como se fosse um hidrocarboneto e adiciona-se ao final das posições dos grupos OH seguido da terminação (di, tri, etc.) ol.
Publicidade
Exemplos:
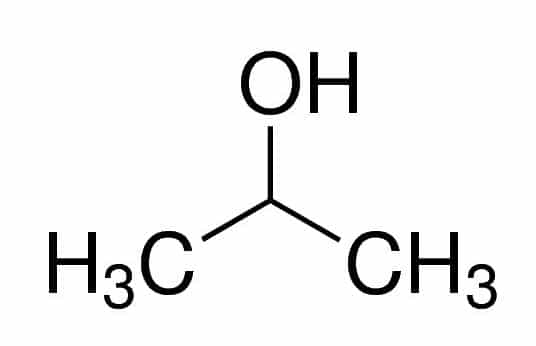
Prop (dos três C na cadeia) + an (das simples ligações) + 2 (da posição do carbono onde o OH se encontra) + ol (sufixo para os álcoois) = propan-2-ol, ou 2-propanol. É um álcool secundário.
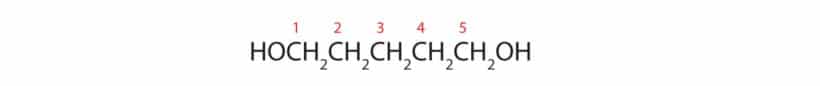
Pent (dos cinco C na cadeia) + ano (das simples ligações e terminação do hidrocarboneto) + 1,5 (das posições dos carbonos onde os OH se encontram) + diol (sufixo para os álcoois, nesse caso um diálcool) = Pentano-1,5-diol.
Publicidade
Aldeídos
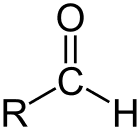
Aldeído é a classe de compostos orgânicos que possuem uma carbonila (C=O) no final da cadeia carbônica, como representado acima, fazendo com que o C da carbonila seja um carbono primário.
Um exemplo de aldeído é o metanal (também conhecido como formaldeído ou, simplesmente, formol) que é usado na conservação de cadáveres e peças em laboratórios de anatomia. Além disso, é muito característico de aldeídos o odor que possuem, muitos destes sendo utilizados em indústria farmacêutica ou alimentícia como flavorizantes e odorizantes.
Nomenclatura
De acordo com a IUPAC, os aldeídos são nomeados de modo parecido ao dos álcoois, substituindo a terminação -o dos hidrocarbonetos, desta vez por -al. A contagem dos carbonos começa a partir do grupo funcional. Apesar disso, muitos são conhecidos por seus nomes usuais, como é o caso do formol.
Exemplos:
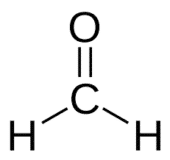
Met (do C na cadeia) + an (das simples ligações) + al (sufixo para os aldeídos) = metanal.
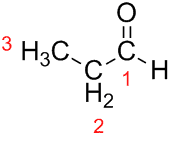
Prop (dos três C na cadeia) + an (das simples ligações) + al (sufixo para os aldeídos) = propanal.
Cetonas
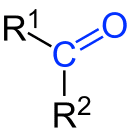
As cetonas são constituídas de uma carbonila (C=O) secundária, ou seja, ligada a dois ligantes orgânicos (R1 e R2). Estes dois grupos podem ser idênticos, formando uma cetona simples (ou simétrica), ou diferentes, formando uma cetona mista (ou assimétrica). R1 e R2 podem ainda estar unidos entre si, fazendo com que a cetona seja cíclica.
A cetona mais conhecida é a propanona, comercialmente chamada de acetona, presente em removedores de esmaltes, solventes de tintas e vernizes.
Nomenclatura
De maneira análoga ao caso dos álcoois e aldeídos, a nomenclatura das cetonas é feita apenas trocando o sufixo -o dos hidrocarbonetos por -ona. Apesar de esse ser o modo indicado pela IUPAC, as cetonas ainda podem ser nomeadas de acordo com os radicais que estão ligados à carbonila, onde primeiramente, por ordem crescente dos números de carbonos, são colocados os radicais correspondentes, terminando com a palavra “cetona”.
Exemplos:
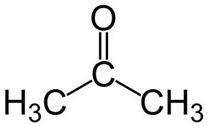
Prop (dos 3 C da cadeia principal) + an (das ligações simples) + ona = propanona ou dimetil-cetona*
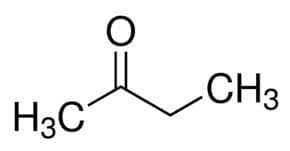
But (dos 4 C da cadeia principal) + an (das ligações simples) + 2 (da posição do carbono da carbonila) + ona = butan-2-ona ou metil-etil-cetona*
*modo alternativo, não oficial
Éteres

São constituintes do grupo dos éteres as moléculas onde um átomo de Oxigênio se encontra ligado entre duas cadeias carbônicas. Da mesma maneira que as cetonas, os éteres podem ser simétricos quando as duas cadeias substituintes forem iguais ou assimétricos, quando forem diferentes.
O éter comum (etóxietano) era usualmente utilizado como anestésico em cirurgias, mas, devido a sua toxicidade, deixou de ser empregado. Hoje em dia, a maioria dos éteres são utilizados como solventes inertes em reações químicas ou para extrair outras substâncias de produtos naturais.
Nomenclatura
De acordo com a IUPAC, há duas maneiras de se nomear os éteres.
A primeira delas consiste em dividir os radicais que fazem parte do éter em mais simples (menor número de carbonos) e mais complexo (maior número de C). Sendo assim, o nome do éter segue a estrutura:
Radical mais simples + OXI (referente aos éteres) + Radical Complexo + terminação de hidrocarbonetos
A segunda consiste em colocar os radicais em ordem alfabética e adicionar a palavra éter ao final.
Exemplos:
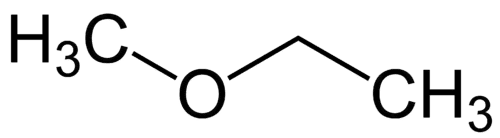
Radical mais simples: metila (1C)
Radical mais complexo: etila (2C)
1 – Met (referente ao mais simples) + oxi (referente aos éteres) + et (referente ao mais complexo) + an (ligações simples) + o (mesma terminação de hidrocarbonetos) = metóxietano
2 – etil-metil-éter (ordem alfabética dos radicais + éter)
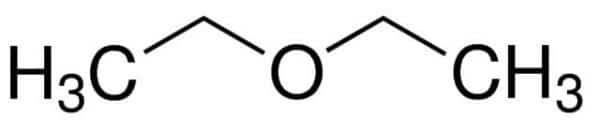
Radicais iguais: etil (2C)
1 – Et (referente aos 2 C) + oxi + Et (dos 2 C) + an (ligações simples) + o (terminação de hidrocarboneto) = etóxietano.
2 – Dietil-éter ou éter dietílico.
Ésteres
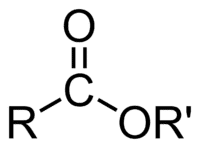
O conjunto de compostos que possuem no meio de sua estrutura essa carbonila substituída de uma cadeia carbônica de um lado (R) e um oxigênio ligado a outra cadeia carbônica do outro é chamado de éster.
Os ésteres são substâncias que possuem odores e sabores característicos. Por conta disso, são muito utilizadas em indústria alimentícia para flavorizar balas, gomas de mascar, refrigerantes, entre outros alimentos.
Nomenclatura
A nomenclatura do éster é formada por um prefixo, que indica o número de carbonos do radical da extremidade que não possui o oxigênio (o carbono da C=O entra na contagem) + um intermediário que indica o tipo da ligação química existente nesse radical + sufixo -oato de, que é característico dos ésteres + o mesmo para o segundo radical + sufixo -ila.
Exemplos:
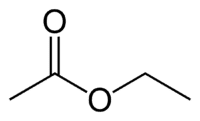
Et (2C do lado que não possui o oxigênio) + an (ligação simples) + oato de (por ser um éster) + et (2C do lado da carbonila que tem o O) + ila = Etanoato de etila
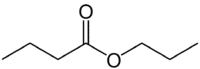
But (4C do lado que não possui o oxigênio) + an (ligação simples) + oato de (por ser um éster) + prop (3C do lado da carbonila que tem o O) + ila = butanoato de propila
Ácidos carboxílicos
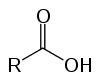
São os compostos orgânicos conhecidos como oxiácidos por conta de sua característica ácida. Possuem em sua estrutura uma (ou mais) carboxila (-RCOOH) ligada à cadeia carbônica.
O ácido acético (ácido etanóico) é um exemplo de ácido carboxílico muito presente no nosso dia-a-dia, já que é o principal constituinte do vinagre de mesa. Os ácidos carboxílicos são, ainda, muito empregados em reações orgânicas realizadas em laboratório.
Nomenclatura
Para nomear os ácidos carboxílicos é facil: começamos com a palavra ácido, seguida pelo nome correspondente ao número de carbonos da cadeia que forma a molécula, o tipo de ligação e a terminação -oico, característica dessa classe.
Exemplos:
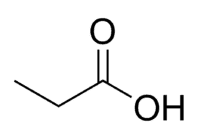
Ácido + Prop (dos 3 C da cadeia, incluindo o da carbonila) + an (ligações simples) + oico = ácido propanoico
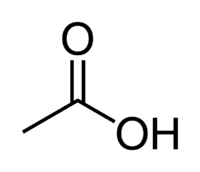
Ácido + Et (dos 2 C da cadeia) + an (ligações simples) + oico = ácido etanoico
Fenóis
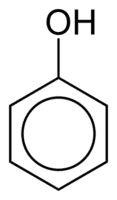
Fenóis são constituídos de um ou mais grupo hidroxil (OH) ligado diretamente a um anel aromático, fato que faz com que sejam diferentes dos álcoois comuns. São classificados de acordo com a quantidade de hidroxilas ligadas ao anel, sendo monofenol (1 OH), difenol (2 OH) ou polifenol (3 ou mais OH).
São utilizados industrialmente na fabricação de antissépticos, fungicidas, explosivos, entre outras.
Nomenclatura
Há várias maneiras de se nomear os fenóis, todas partindo do pressuposto que o anel aromático é a cadeia principal na hora de numerar os carbonos onde se encontram os substituintes. A primeira delas é de adicionar o radical correspondente ao substituinte antes da palavra fenol. Outra maneira é de indicar esse radical e, em seguida, completar com hidróxibenzeno.
Exemplos:
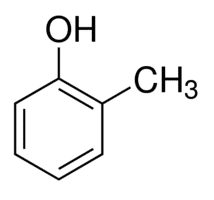
2 (posição do substituinte) + metil (nome do substituinte) + fenol = 2-metil-fenol ou 2-metil-hidróxibenzeno.
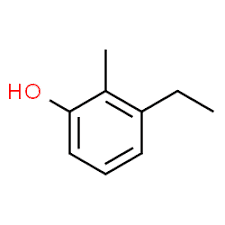
3 (posição do substituinte) + etil (nome do substituinte em ordem alfabética) + 2 (posição do segundo substituinte) + metil (nome) + fenol = 3-etil-2-metil-fenol ou 3-etil-2-metil-hidróxibenzeno.
Como vimos em química orgânica, quando as funções possuem o átomo de oxigênio, além dos átomos de carbono e hidrogênio, elas são chamadas de funções oxigenadas e elas estão mais presentes em nossas vidas do que imaginamos! Que tal treinar o que estudamos com alguns exercícios?
Referências
Solomons, T. W. G., Fryhle, C. Química Orgânica. John Wiley & Sons, 10ª ed, 2009.
Paula Y. Bruice. Química Orgânica. Pearsons, 7ª ed, 2014.

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Funções Oxigenadas. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/funcoes-oxigenadas. Acesso em: 24 de February de 2026.
1. [UNB]
Um exemplo de óleo essencial é o óleo de citronela, extraído da planta conhecida como capim citronela. Os seus principais constituintes são o citronelal e o citronelol, cujas estruturas são mostradas a seguir:
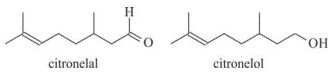
De acordo com as informações, a nomenclatura oficial do citronelal é 3-metiloct-2-enal? Justifique.
A afirmação está errada. O citronelal é um aldeído composto de uma cadeia carbônica de 8 átomos, com uma dupla ligação entre os carbonos 6 e 7, começando a contagem a partir do grupo funcional, e duas ramificações de metila nos carbonos 3 e 7. Portanto o nome oficial do composto é 3,7-dimetil-oct-6-enal.
2. [FM Petrópolis RJ]
O Propionato de Drostanolona é um esteroide, também conhecido pelo nome comercial Masteron, preferido entre os fisiculturistas, por apresentar uma série de vantagens sobre outras drogas sintéticas.
Sua fórmula estrutural é
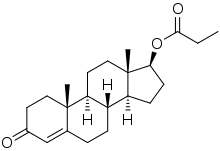
e apresenta as seguintes funções orgânicas:
a) aldeído e ácido carboxílico
b) aldeído e éter
c) éter e cetona
d) éster e fenol
e) éster e cetona
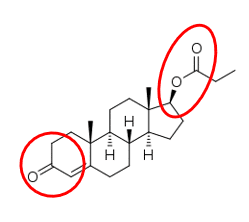
À esquerda está o grupo cetona e à direita se encontra o grupo éster. Portanto a resposta certa é a leta E (éster e cetona)
3. [UFRJ]
O propanotriol, quando submetido a um aquecimento rápido, desidrata-se, formando a acroleína que apresenta um cheiro forte e picante. Essa propriedade constitui um meio fácil e seguro de se diferenciarem as gorduras verdadeiras dos óleos essenciais e minerais, pois, quando a gordura é gotejada sobre uma chapa superaquecida, também desprende acroleína. Observe o que acontece com o propanotriol:
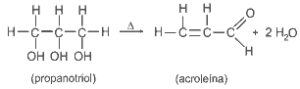
a) Quais as respectivas funções químicas existentes no propanotriol e na acroleína?
b) Indique, segundo a IUPAC, a nomenclatura da acroleína.
a) Propanotriol: triálcool e Acroleína: aldeído
b) Nome oficial da acroleína: prop-2-enal