As pilhas são dispositivos que transformam energia química em energia elétrica através de reações de oxirredução. Se a reação interna for reversível, a pilha é recarregável e recebe o nome de bateria para haver diferenciação. São utilizadas em diversos dispositivos eletrônicos, como relógios, controles remoto e celulares. Saiba como funciona e como são feitas as pilhas.
Publicidade
O que é a pilha
As pilhas são dispositivos que transformam a energia de reações químicas em eletricidade, através de transferência de elétrons de forma espontânea. Dessa forma, a energia elétrica somente é fornecida durante o tempo que a reação química está ocorrendo. A corrente gerada é aproveitada para o funcionamento de equipamentos eletrônicos, como alguns brinquedos, relógios de parede e celulares ou dispositivos mais complexos.
Relacionadas
Em uma pilha, a reação de oxirredução que acontece é irreversível, ou seja, quando ela termina, a pilha para de funcionar. Existem as pilhas cuja reação é reversível e, consequentemente, podem ser recarregadas pela aplicação de energia elétrica no sentido oposto para nova utilização. Para haver distinção, elas são denominadas “baterias”.
Como funciona a pilha
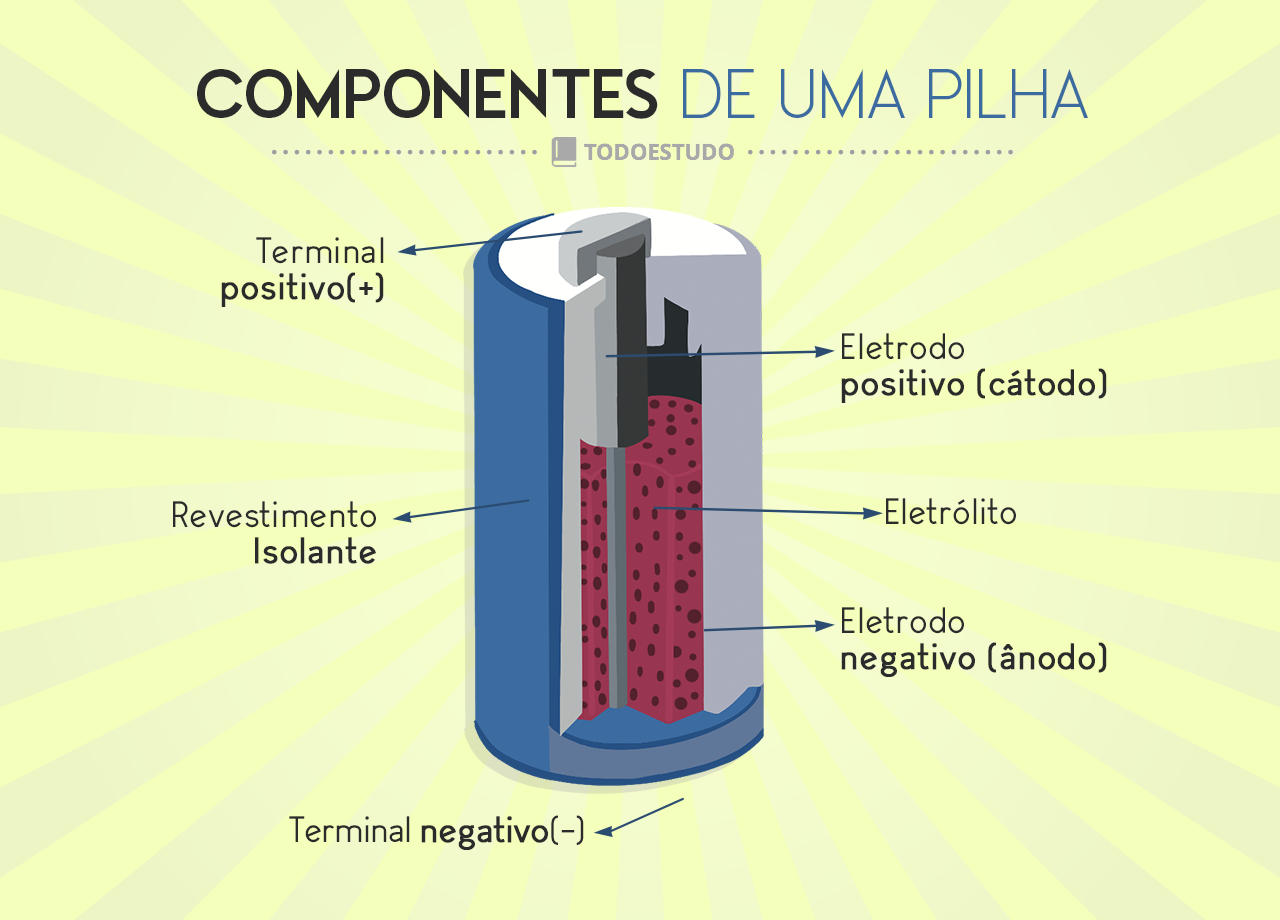
Seu funcionamento é baseado na transferência de elétrons de um polo negativo (ânodo) para um polo positivo (cátodo). Sendo assim, o ânodo cede os elétrons e o cátodo os recebe. Os elétrons passam pelo circuito interno do aparelho em que a pilha está sendo usada antes de chegar até o cátodo. Além disso, uma pasta eletrolítica também constitui a pilha, o que fará o balanceamento de cargas durante a reação de oxirredução.
Como a pilha é feita
Os eletrodos da pilha são metais diferentes que proporcionam a superfície em que ocorre a reação de oxirredução. Eles são mantidos em compartimentos isolados, imersos em uma solução ou pasta fonte de íons (eletrólito) e separados por uma membrana porosa. É preciso haver esse isolamento entre os dois compartimentos para que a transferência eletrônica aconteça por fora do sistema da pilha (circuito externo).
A imagem abaixo mostra como é o interior das pilhas mais comuns hoje em dia.
Publicidade
Tipos de pilhas
Com funcionamento semelhante, existem diferentes metais que podem ser utilizados na fabricação das pilhas, garantindo que elas tenham características distintas. Dessa forma, veja alguns dos tipos de pilhas mais comuns, encontrados nos aparelhos eletrônicos do cotidiano.
Pilha de Daniell
Foi a primeira célula eletroquímica montada com capacidade para manter uma corrente elétrica constante. É constituída de um eletrodo de zinco imerso numa solução de sulfato de zinco (ânodo) e uma placa de cobre imersa numa solução de sulfato de cobre (cátodo). As soluções são unidas por uma ponte salina de cloreto de potássio.
Publicidade
Pilha seca de Leclanché
Também chamada pilha ácida, é a pilha comum. Não é recarregável, visto que é uma pilha e a reação que ocorre é irreversível. Seu ânodo é o cilindro de zinco metálico que a reveste. Por outro lado, o cátodo é um eletrodo de carbono (grafite), recoberto por uma camada de óxido de manganês e carvão em pó, além de cloreto de amônio com cloreto de zinco que funciona como eletrólito.
Pilha alcalina
Essa pilha possui caráter básico, por isso o nome “alcalino”. Também não é recarregável, porém, ela possui um condutor eletrolítico mais potente que a pilha comum, portanto ela tem maior duração, recomendada para aparelhos que demandam mais energia. O ânodo é uma placa de zinco porosa imersa numa pasta de hidróxido de zinco ou sódio (eletrólito) e o cátodo é feito de dióxido de manganês compactado.
Bateria de íons de lítio
É uma bateria recarregável, ou seja, a reação de oxirredução é reversível. É encontrada em aparelhos eletrônicos como os celulares, pois possuem a capacidade de armazenar muita energia. Geralmente, o ânodo é feito de carbono e o cátodo é um óxido metálico. Já o eletrólito é constituído de um sal de lítio dissolvido em solventes orgânicos
Bateria de chumbo e ácido
São as baterias de automóveis. É uma associação em série de um conjunto de pilhas, fornecendo uma tensão nominal de 12 Volts. O ânodo é o chumbo metálico e o cátodo é feito de dióxido de chumbo. Ambos são mergulhados na solução eletrolítica de ácido sulfúrico.
Existem ainda diferentes pilhas que possuem finalidades distintas, que variam desde os componentes internos até a otimização dos formatos.
Vídeos sobre as pilhas e baterias
Agora que o conteúdo foi apresentado, veja alguns vídeos selecionados para ajudar a assimilar o conteúdo estudado.
O funcionamento da primeira pilha desenvolvida
A pilha de Daniell foi um dos primeiros dispositivos desenvolvidos que converte energia química em energia elétrica constante. Nessa célula galvânica ocorrem simultaneamente reações de oxidação e redução, que proporcionam o fluxo de elétrons de um pólo para outro. Entenda como ela funciona e toda teoria por trás da pilha de Daniell
Por dentro de uma pilha comum
As pilhas de Leclanché, também chamadas pilhas ácidas ou de zinco-carvão são as pilhas comuns utilizadas em relógios ou controles remotos. A reação que acontece em seu interior é irreversível, portanto a pilha é descartável. Veja um aporte histórico do desenvolvimento das pilhas, entenda as reações químicas que ocorrem e descubra o que tem dentro de uma pilha comum..
Diferença entre bateria de moto e pilha comum
A bateria utilizada em motos é um tipo de pilha, visto que transformam a energia química em energia elétrica. Seus componentes internos, ou seja, cátodo e ânodo, são dióxido de chumbo e chumbo metálico, respectivamente. Veja como é dentro de uma bateria de moto e observe a diferença entre ela com a pilha comum vista anteriormente.
Em síntese, as pilhas são dispositivos que transformam a energia química em energia elétrica por reações de oxirredução, possibilitando a portabilidade de vários equipamentos eletrônicos. Não pare de estudar por aqui, veja mais sobre os polos das pilhas, ânodo e cátodo.
Referências
Química: a ciência central (1999) – Theodore L. Brown, Eugene H. LeMay, Bruce E. Bursten e Julia R. Burdge
Fundamentos de Química Analítica (1963) – Douglas A. Skoog, Donald M. West, F. James Holler e Stanley R. Crouch
Química Analítica (1971) – Gary D. Christian

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Pilhas. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/pilhas. Acesso em: 27 de February de 2026.
1. [PUC-Camp]
Nas pilhas secas, geralmente utilizadas em lanternas, há um envoltório de zinco metálico e um bastão central de grafite rodeado de dióxido de manganês e pasta úmida de cloreto de amônio e de zinco, conforme a figura a seguir.
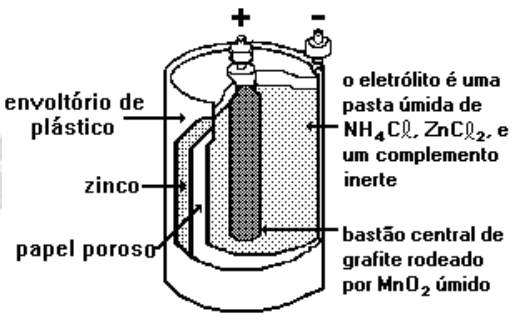
As reações são complexas, porém quando o fluxo de corrente é pequeno, podem ser representadas por:
Ânodo: Zn(s) → 2e– + Zn2+
Cátodo: 2MnO2(s) + 2NH4+ + 2e– → Mn2O3(s) + 2NH3 + H2O
À medida que a pilha seca vai sendo gasta há aumento nas massas de:
a) zinco metálico e água.
b) dióxido de manganês e água.
c) sais de amônio e de zinco.
d) zinco metálico e dióxido de manganês.
e) amônia, água, sais de zinco e óxido de manganês III
Para chegar à resposta dessa questão é simples. Somando as semi-reações da pilha, é possível determinar a reação global:
Zn(s) + 2MnO2(s) + 2NH4+ → Zn2+ + Mn2O3(s) + 2NH3 + H2O
Os produtos dessa reação são o óxido de manganês III (Mn2O3(s)), amônia (NH3), água (H2O) e íons de zinco (Zn2+). Portanto a alternativa correta é a letra e.
2. [FUC-MT]
Nas pilhas eletroquímicas obtém-se corrente elétrica devido à reação de oxidorredução. Podemos afirmar que:
a) no cátodo, ocorre sempre a semi-reação de oxidação.
b) no cátodo, ocorre sempre a semi-reação de redução.
c) no ânodo, ocorre sempre a semi-reação de redução.
d) no ânodo, ocorre sempre a oxidação e a redução simultaneamente.
e) no cátodo, ocorre sempre a oxidação e a redução simultaneamente.
Na pilha, a reação de oxidação acontece no ânodo (ele cede os elétrons) e a redução acontece no cátodo (eletrodo que recebe os elétrons). Em hipótese alguma das duas reações podem acontecer simultaneamente no mesmo eletrodo. Portanto, a alternativa correta é a letra b) no cátodo, ocorre sempre a semi-reação de redução.