A eletropositividade é a propriedade periódica que mostra a tendência de um átomo de perder elétrons, ou seja, de formar cátions. É uma característica muito presente nos elementos metálicos. Isso acontece com o intuito de atingir a estabilidade eletrônica, em outras palavras, obedecer à regra do octeto. Veja mais sobre essa propriedade e entenda como ela ocorre na tabela periódica.
Publicidade
O que é eletropositividade?
Também chamada de caráter metálico, a eletropositividade é a propriedade que os elementos possuem de apresentar uma tendência de perder elétrons. Dessa forma, quando um elemento é muito eletropositivo, ele tende a formar cátions, ou seja, íons de carga positiva, com maior facilidade. Nesse sentido, é chamada de caráter metálico, porque os metais apresentam essa característica quando combinados.
Relacionadas
Os elementos perdem elétrons para atingir a estabilidade eletrônica, ou seja, obedecer à regra do octeto. Dessa forma, os elementos da família dos gases nobres (grupo 18) são excluídos dessa propriedade e não possuem valores de eletropositividade, visto que eles já possuem oito elétrons na camada de valência e não se combinam com outros elementos, ou seja, são inertes.
Eletropositividade e eletronegatividade
A eletronegatividade é o oposto da eletropositividade. É a tendência de um elétron de receber um elétron. Átomos eletronegativos formam ânions. Ambas são propriedades periódicas, porém, enquanto a eletronegatividade de um elemento faz com que ele atraia elétrons, o caráter metálico faz com que essas cargas negativas sejam expulsas da eletrosfera dos átomos. Um exemplo dessa oposição entre os conceitos é de que o elemento mais eletronegativo da tabela periódica (flúor) é o que apresenta o menor valor de eletropositividade.
Eletropositividade na tabela periódica
Por ser uma propriedade periódica, o caráter metálico varia em intervalos regulares com o aumento ou diminuição de número atômico ao longo da tabela. Isso significa que essa tendência de perder os elétrons segue um padrão, como mostrado a seguir.
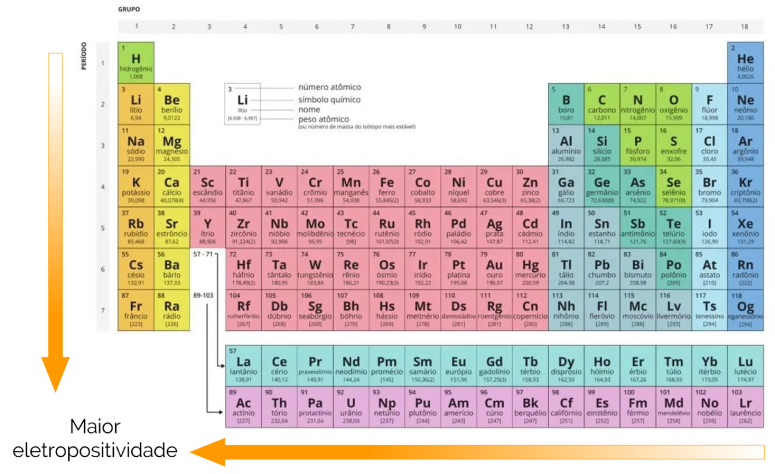
O que acontece com essa propriedade pode ser dividido em três fatores importantes: raio atômico, períodos e grupos:
Publicidade
- Raio atômico: quanto maior o número atômico e, consequentemente, maior o raio dos átomos, mais camadas eletrônicas o elemento tem, portanto, os elétrons ficam mais distantes do núcleo. Isso faz com que a eletropositividade aumente com o aumento do raio.
- Períodos: o caráter metálico cresce da direita para a esquerda, visto que em um mesmo período, os elementos possuem a mesma quantidade de camadas eletrônicas, mas aqueles de menor número atômico têm menos elétrons, fazendo com que a atração pelo núcleo seja menor e a tendência de perder elétron é maior.
- Grupos: a eletropositividade cresce de cima para baixo, pois ao descer em um mesmo grupo, os períodos aumentam com o raio atômico, distanciando a camada de valência do núcleo e aumentando a tendência de perder os elétrons.
Nesse sentido, o Frâncio (Fr) é o elemento mais eletropositivo da tabela periódica, pois se encontra no primeiro grupo (metais alcalinos) e no último período. É, também, o elemento com o maior raio atômico.
Vídeos sobre o caráter metálico dos elementos químicos
Agora que o conteúdo foi apresentado, veja alguns vídeos que foram selecionados para ajudar a assimilar o tema estudado.
O que é a eletropositividade
Publicidade
Também chamada de caráter metálico, essa propriedade periódica é o oposto da eletronegatividade. É a tendência dos átomos de perder elétrons e, consequentemente, formar cátions. Ela tem o mesmo comportamento que o raio atômico na tabela periódica. Entenda mais como se dá o crescimento do caráter metálico dos elementos químicos e veja outras propriedades periódicas correlacionadas.
A eletropositividade e a reatividade dos metais
A tendência de perder elétrons está diretamente correlacionada com a reatividade dos metais, visto que quanto mais fácil um elemento perde um elétron, mais ele tende a sofrer o processo de oxidação. Isso é importante para prever a ocorrência de reações químicas. Veja um truque que ajuda a lembrar a ordem da fila de reatividade dos metais e aprenda a analisar se uma reação tem, ou não, possibilidade de acontecer.
Eletronegatividade e eletropositividade
Qual a diferença entre eletronegatividade e eletropositividade? São conceitos diretamente opostos. Uma diz respeito a tendência de ganhar elétrons e o outro de perder elétrons. Entenda, de uma vez por todas, a diferença entre essas duas propriedades periódicas muito recorrentes em vestibulares de todo Brasil.
Em síntese, a eletropositividade é o caráter metálico de um elemento, ou seja, sua tendência de perder elétrons e formar cátions. É observada quando os elementos estão combinados com outros e é o oposto da eletronegatividade. Não pare de estudar por aqui, aprenda sobre uma classe de elementos eletropositivos, os metais de transição.
Referências
Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente (2005) – Peter Atkins e Loretta Jones
Química: a ciência central (1999) – Theodore L. Brown, Eugene H. LeMay, Bruce E. Bursten e Julia R. Burdge
Química Inorgânica (1992) – Peter Atkins, Duward F. Shriver e Cooper H. Langford

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Eletropositividade. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/eletropositividade. Acesso em: 27 de February de 2026.
1. [UTFPR]
Na tabela esquemática, a seguir, está apresentado o sentido de crescimento de uma propriedade periódica. Propriedade periódica é aquela cujos valores para os diversos elementos crescem e decrescem em função do número atômico crescente. Assinale a propriedade que apresenta este sentido de crescimento.

a) eletronegatividade (exceto os gases nobres).
b) eletropositividade (exceto os gases nobres).
c) energia de ionização.
d) densidade.
e) volume atômico.
O sentido de crescimento mostrado é de cima para baixo (nos grupos) e da esquerda para a direita (nos períodos), então diz respeito à b) eletropositividade (exceto os gases nobres).
2. [UFV-MG (adaptada)]
A eletropositividade, o potencial de ionização e o raio atômico são exemplos de propriedades periódicas dos elementos. Coloque os metais alcalinos Li, Na, K, Rb, Cs em ordem crescente de eletropositividade.
Por serem metais alcalinos, todos os elementos fazem parte da família 1A. Seus números atômicos são:
Li = 3
Na = 11
K = 19
Rb = 37
Cs = 55
A partir disso, é possível dizer que o raio atômico cresce à medida que cresce o número atômico, visto que Z = quantidade de elétrons e quanto mais elétrons um átomo possui, maior deve ser o seu raio, para acomodar todos os elétrons. Como a propriedade periódica de eletropositividade tem o mesmo comportamento que o raio atômico, a ordem crescente de eletropositividade é: Li < Na < K < Rb < Cs.