Os metais de transição constituem um grupo de elementos da tabela periódica. Localizado no centro, entre os grupos 3 e 12 da tabela, é a maior seção da tabela. Têm esse nome porque todos os elementos que fazem parte do grupo são metálicos. Saiba mais sobre esses elementos e entenda a diferença entre os metais de transição interna e externa.
Publicidade
O que são metais de transição?
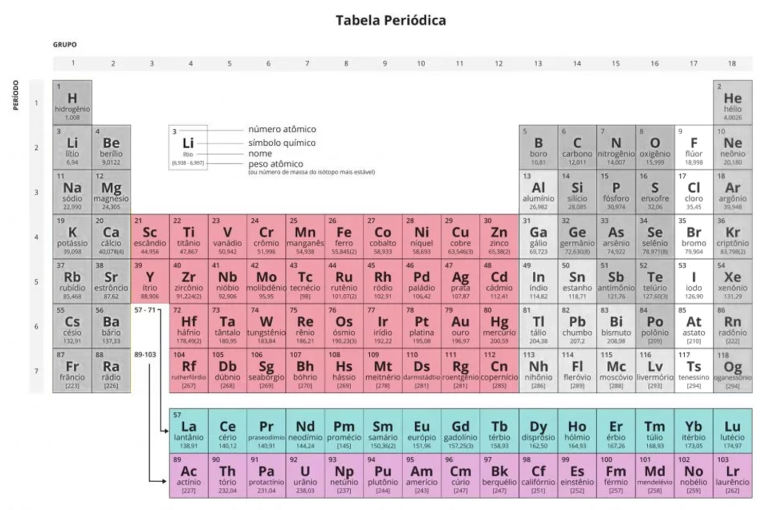
Os metais, ou elementos de transição são os elementos que se localizam entre os elementos representativos, ou seja, na região central da tabela periódica. São aqueles pertencentes aos grupos 3-12. São átomos que possuem o subnível d incompleto. Portanto, recebem o nome de “transição” pela passagem com a adição sucessiva de elétrons ao orbital d, da família 2 (com o subnível de maior energia s completo) para a família 13 (subnível p de maior energia).
Relacionadas
Como o próprio nome já diz, todos os elementos da classe são metálicos. Os metais mais conhecidos como ferro, cobre, ouro, prata e níquel fazem parte dos elementos do bloco d. Essa classe de elementos se divide em duas subclasses: os metais de transição externa e interna. Além disso, possuem outras características interessantes. Veja a seguir.
Características dos metais de transição
- Tendem a formar compostos coloridos, chamados complexos ou compostos de coordenação, como resultado da transição eletrônica entre orbitais d-d;
- Formam compostos com muitos estados de oxidação. O manganês (Mn), por exemplo, possui 10 estados de oxidação, que vão desde -3 até +7;
- São paramagnéticos, ou seja, apresentam atração a um campo magnético externo quando possuem um ou mais elétrons desemparelhados;
- Podem ser utilizados como catalisadores de reações químicas por conta das propriedades de formação de complexos e de seus inúmeros estados de oxidação;
- Por serem metais, possuem elevados pontos de ebulição e fusão (com exceção do mercúrio, o único elemento líquido) e são bons condutores de energia elétrica e térmica.
Como visto, as características desses elementos são muitas, motivo pelo qual muitos cientistas dedicam suas vidas para o estudo dos compostos de coordenação, por exemplo. Agora, entenda mais sobre a classificação existente entre os elementos de transição.
Metais de transição externa
Os chamados elementos de transição externa são os que possuem o subnível d mais energético, portanto possuem o orbital d incompleto. São menos reativos que os metais alcalinos terrosos. Agrupa os elementos em três séries principais, sendo a primeira com os elementos de Z = 21 até 30; a segunda com Z = 39 até 48; e, por fim, a terceira com Z = 72 até 80. Veja alguns dos metais de transição externa.
- Ferro (Fe): Z = 26, é um dos mais conhecidos. Possui propriedades magnéticas e é utilizado na construção de estruturas ou para formar ligas metálicas com o carbono (aço);
- Tungstênio (W): Z = 74, é o metal com o maior ponto de fusão do grupo, de cerca de 3400 °C. Isso garantiu que esse elemento fosse muito utilizado como filamento de lampadas incandescentes;
- Mercúrio (Hg): Z= 80, é o único metal líquido a temperatura ambiente. É utilizado na construção de termômetros, por sua expansão térmica.
Aqui estão listados apenas alguns, afinal de contas, os metais de transição externa são muitos e possuem diversas características e aplicações. Estão inclusos nesse grupo, ainda, o ouro (Au), a prata (Ag), o cobre (Cu), a platina (Pt), entre outros.
Publicidade
Metais de transição interna
Os metais de transição interna correspondem aos elementos da série dos lantanídeos e actinídeos, ou seja, aqueles que pertencem à família 3, no sexto e sétimo períodos, respectivamente. Lantanídeos abrangem números atômicos de 57 até 71 e os actinídeos de Z = 83 até 103. Há muito debate ainda sobre a inclusão ou não desses elementos no grupo dos metais de transição. Isso porque eles possuem o orbital f incompleto, sendo assim, muitos cientistas dizem que eles são elementos do bloco f, apenas. Veja alguns exemplos de metais de transição interna.
- Cério (Ce): Z = 58, é um elemento de transição interna da classe dos lantanídeos. É um metal utilizado na fabricação de ligas metálicas que são transformadas em pedra de ignição para isqueiros ou, quando na forma de óxido, como agente auto-limpante de fornos.
- Urânio (U): Z = 92, é um elemento de transição interna da classe dos actinídeos, o elemento radioativo mais conhecido, utilizado em larga escala em usinas nucleares, como combustível na produção de energia elétrica.
- Tório (Th): Z = 90, actinídeo. É um metal que, quando na sua forma de óxido, possui o maior ponto de ebulição entre todos os óxidos existentes. Por conta disso, é utilizado como recobrimento das mantas (camisas) de lampiões a gás. Quando aquecido em chamas, o óxido de tório gera uma luz intensa.
Apesar de serem classificados como terras-raras, alguns dos metais de transição interna ainda possuem diversas aplicações. Por outro lado, a maioria deles possui isótopos radioativos com elevados tempos de meia-vida, portanto, são elementos que emitem radioatividade.
Vídeos sobre os elementos de transição
Agora que o conteúdo já foi apresentado, veja alguns vídeos que foram selecionados para ajudar a assimilar o tema estudado.
Publicidade
Quais são os elementos de transição
Os metais de transição são os elementos do bloco d da tabela periódica, localizados entre os grupos 3 e 12. De modo geral, são metais com elevados pontos de ebulição e de fusão. Alguns deles, ainda, conseguem formar compostos complexos de coloração variada. Veja mais sobre essa classificação de elementos químicos e quais são todos os metais de transição.
Experiência com a cor dos metais do bloco d
O cobalto é um metal de transição que possui uma característica interessante. Ele forma complexos, ou seja, compostos de coordenação, com outras moléculas. Na sua forma anidra (sem água) o sal Cloreto de Cobalto (CoCl2) tem coloração azul. Porém, quando forma complexo com 6 moléculas de água, passa a ter uma coloração rosa. Entenda mais sobre esse composto com essa experiência, que tem como base o “galo do tempo”, que muda de cor em dias chuvosos.
Elementos de transição na tabela periódica
A tabela periódica está organizada de uma forma que existe uma divisão clara entre os grupos de elementos, tomando como base sua configuração eletrônica. Veja quais são essas divisões e saiba identificar os elementos de transição na tabela.
Em síntese, os metais de transição são os elementos que constituem o bloco d da tabela periódica. Todos são metais e apresentam características únicas, graças ao preenchimento parcial do orbital eletrônico d. Não pare de estudar por aqui, saiba mais sobre os elementos representativos da classe dos metais alcalinos.
Referências
Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente (2005) – Peter Atkins e Loretta Jones
The Elements – A Visual Exploration of Every Known Atom in the Universe (2009) Theodore Gray
Química Inorgânica (1992) – Peter Atkins, Duward F. Shriver e Cooper H. Langford

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Metais de transição. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/metais-de-transicao. Acesso em: 04 de February de 2026.
1. [PUCCAMP-SP]
O subnível de maior energia do átomo de certo elemento químico é 4d5. Esse elemento é um metal:
a) de transição do 4º período da tabela periódica.
b) de transição do grupo 5B da tabela periódica.
c) representativo do 4º período da tabela periódica.
d) representativo do 5º período da tabela periódica.
e) de transição do 5º período da tabela periódica.
Realizando a distribuição eletrônica desse átomo:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d5
Como ele tem o subnível d como o de maior energia, esse elemento é um metal de transição. Pela distribuição eletrônica, percebe-se que a última camada de elétrons é a 5s2, portanto o elemento se encontra no quinto período da tabela periódica. Dado isso, a alternativa correta é a letra e) de transição do 5º período da tabela periódica.
Ainda é possível determinar qual elemento químico é esse. Somando todos os elétrons que foram distribuídos (43), sabe-se também o número atômico do elemento. É o Tecnécio (Z = 43), que se encontra na família 7B da tabela, comprovando ser um metal de transição.
2. [UNIMEP-SP]
Nos metais de transição interna, o elétron de diferenciação (o mais energético) se localiza no:
a) subnível “s”, da última camada.
b) subnível “p”, da penúltima camada.
c) subnível “f”, da antepenúltima camada.
d) subnível “d”, da antepenúltima camada.
e) subnível “g”, da penúltima camada.
Metais de transição interna também são chamados de elementos do bloco f da tabela periódica. Isso porque seu elétron mais energético se encontra nesse subnível. Portanto a alternativa correta é a letra c) subnível “f”, da antepenúltima camada.