A energia de ativação é a quantidade de energia mínima que os reagentes de uma reação química precisam absorver para ela ocorrer. Em outras palavras, é o que determina a ocorrência de reações químicas, aliado de outros fatores, como colisões efetivas entre moléculas. Aprenda sobre esse fator tão importante para a execução de todas as reações químicas.
Publicidade
O que é energia de ativação
Também chamada de barreira energética, a energia de ativação é a quantidade mínima de energia necessária para que ocorra uma reação química entre dois ou mais reagentes. É uma quantidade de energia que varia de uma reação para outra. Ela pode ser fornecida termicamente, pelo aquecimento do meio reacional, por atrito (como é o caso de palitos de fósforo) ou, ainda, pela ação da luz (energia eletromagnética). Sua unidade de medida pode ser joules por mol (J/mol), quilojoules por mol (kJ/mol) ou quilocalorias por mol (kcal/mol)
Relacionadas
A colisão das moléculas de reagentes com energia de ativação suficiente e orientação ideal resulta na formação dos chamados “complexos ativados” ou “estado de transição”. É um composto intermediário e instável formado entre produtos e reagentes que logo se decompõe, transformando-se nos produtos. Sendo assim, o ponto de energia máxima e que define a dimensão da barreira energética é a formação desse estado de transição.
Fórmula da energia de ativação
É possível determinar o valor dessa barreira energética de uma reação química pela equação a seguir:
Ea = Hca – Hr
- Ea: energia de ativação (J/mol)
- Hca: energia do complexo ativado (J/mol)
- Hr: energia dos reagentes (J/mol)
É importante ressaltar que as energias do complexo ativado e reagente são expressas na forma de entalpia (H). Quanto maior for o valor de Ea, mais lenta é a reação. Por outro lado, quanto menor for o valor de Ea, menor é a barreira energética e a reação ocorre mais rapidamente. Esse é o princípio de funcionamento dos catalisadores. Eles aumentam a velocidade da reação por proporcionar um caminho reacional novo, portanto, com menor energia.
Publicidade
Gráfico da energia de ativação
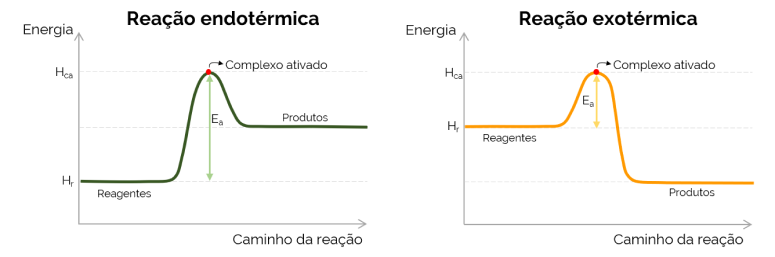
Graficamente, a energia de ativação é representada pela “montanha” formada com o aumento de energia no decorrer da reação química. No ponto mais alto da curva se encontra o complexo ativado, portanto, é a etapa determinante da Ea, visto que a partir desse ponto, os produtos começam a se formar e a energia diminui. Em concordância com a equação apresentada anteriormente, a Ea é a diferença entre as energias do complexo ativado e dos reagentes. Por fim, reações exotérmicas tendem a ter menores valores de Ea quando comparadas com reações endotérmicas.
Vídeos sobre a energia de ativação
Agora que o conteúdo já foi apresentado, veja alguns vídeos que foram selecionados para ajudar a assimilar o tema estudado.
O que é a barreira energética?
Publicidade
Em uma reação química, a quantidade de energia que os reagentes precisam absorver para que se transformem em produtos é chamada de energia de ativação, ou barreira energética. Aprenda mais sobre esse assunto e saiba como calcular o valor de Ea de reações diretas e inversas.
Diferença entre energia de ativação e a variação de entalpia
Por ser um assunto muito cobrado em vestibulares, a energia de ativação é facilmente confundida com a variação de entalpia de reações químicas. Para não ficar com essa dúvida, veja esse vídeo explicativo e saiba como interpretar corretamente exercícios que envolvem esses assuntos.
Exercício resolvido de cinética química
A melhor maneira de testar os conhecimentos é fazendo exercícios dos assuntos estudados. Veja a resolução dessa questão do ITA (2002). É uma questão que parece complexa, porém tem uma resolução simples. Aprenda a interpretar o exercício e resolvê-lo da maneira correta.
Em síntese, a energia de ativação é a quantidade mínima de energia necessária para que uma reação química aconteça. Ela é menor em reações exotérmicas, ou seja, que liberam calor, quando comparada com as de reações endotérmicas. Não pare de estudar por aqui, veja mais sobre reações de combustão, cuja energia de ativação é fornecida pelo calor.
Referências
Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente (2005) – Peter Atkins e Loretta Jones
Química: a ciência central (1999) – Theodore L. Brown, Eugene H. LeMay, Bruce E. Bursten e Julia R. Burdge
Fundamentos de Físico-Química (1986) – Gilbert Castellan

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Energia de ativação. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/energia-de-ativacao. Acesso em: 03 de February de 2026.
1. [PUC-RS (adaptada)]
Dada as afirmações:
I — Uma reação com energia de ativação 40 kJ é mais lenta que uma outra reação que apresenta energia de ativação igual a 130 kJ.
II — A adição de um catalisador a uma reação química proporciona um novo “caminho” de reação, no qual a energia de ativação é diminuída.
III — Um aumento de temperatura geralmente provoca um aumento na energia de ativação da reação.
IV — A associação dos reagentes com energia igual à energia de ativação constitui o complexo ativado.
Conclui-se que estão somente corretas:
a) I e II
b) I e III
c) II e IV
d) I, III e IV
e) II, III e IV
Analisando as afirmações
I — ERRADA. Reações lentas tendem a ter a energia de ativação maior que reações mais rápidas.
II — CORRETA. O catalisador proporciona um meio de reduzir a barreira energética, ou seja, diminuir a energia de ativação, fazendo com que uma reação química lenta ocorra de maneira mais rápida.
III — ERRADA. Em geral, o aumento da temperatura faz com que a energia de ativação diminua.
IV — CORRETA. O complexo ativado é justamente essa associação dos reagentes após colisões efetivas, que atingiram a energia necessária para que a reação ocorra.
Sendo assim, a alternativa correta é a letra c) II e IV.
2. [MACKENZIE-SP)]
Analisando o gráfico representativo do caminho da reação A + B → C, pode-se dizer que o valor da energia de ativação, em kcal/mol, e o tipo de reação são, respectivamente:
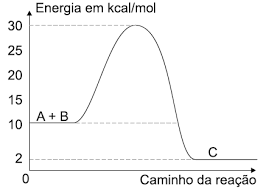
a) 08 e exotérmica.
b) 20 e endotérmica.
c) 20 e exotérmica.
d) 28 e endotérmica.
e) 30 e endotérmica.
O valor da energia de ativação é calculado pela equação Eat = Hc.a. – HR.
Pelo gráfico:
Hc.a. = 30 kcal/mol
HR = 10 kcal/mol
Então o valor de Eat é 20 kcal/mol.
Como a energia dos reagentes é maior que a energia dos produtos, a reação é exotérmica. Portanto, a alternativa correta é a letra c) 20 e exotérmica.