A geometria molecular estuda a disposição espacial dos átomos em uma molécula e como isso afeta as propriedades da mesma. Para isso, considera-se as propriedades físicas e químicas de um determinado composto. No decorrer da matéria, confira a definição do conceito, tipos, exemplos e videoaulas.
Publicidade
O que é geometria molecular?
A geometria molecular consiste na forma espacial que uma molécula adquire quando seus átomos formam ligações. Nessa união, ocorre uma organização das espécies ao redor do átomo central (no caso de três átomos ou mais), resultando em uma molécula que parece uma figura geométrica.
A forma estrutural de um composto é importante, pois está associada a sua polaridade e as suas propriedades físicas e químicas. Como consequência, a geometria molecular também influencia no modo como as moléculas interagem entre si. Isso inclui os sistemas biológicos – alguns compostos interagem exclusivamente com receptores específicos devido à estrutura tridimensional da molécula.
Por que ocorre geometria molecular?
A geometria molecular é resultado da repulsão entre os pares de elétrons ao redor dos átomos: os pares ligantes e os não ligantes se repelem. Essa organização leva à formação de um composto mais estável, pois minimiza a energia necessária para manter os átomos unidos. Caso contrário, o efeito de repulsão rompiria as ligações facilmente.
Relacionadas
Tipos de geometria molecular
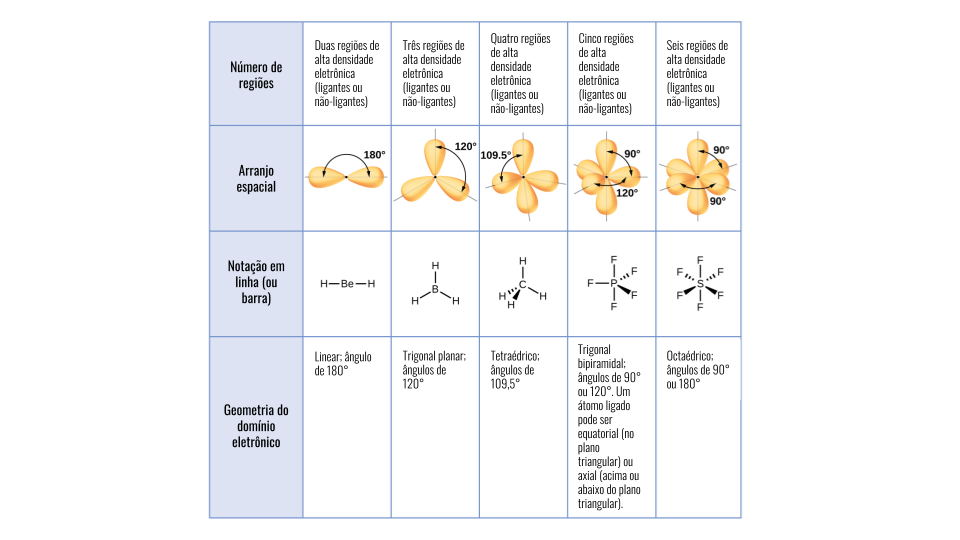
De acordo com a quantidade de pares de elétrons ligantes e não ligantes ao redor do átomo central, uma molécula pode assumir alguns tipos de conformação, como apresentados na imagem. Abaixo, confira detalhes sobre cada tipo de geometria.
Linear
Ocorre em moléculas que apresentam fórmula molecular do tipo A2 ou em compostos do tipo AB2. No primeiro caso, como existem apenas dois átomos ligados, a menor distância entre dois pontos é uma reta. Já o segundo caso ocorre quando o átomo central não apresenta pares eletrônicos não ligantes.
Publicidade
Angular
Compostos com fórmula molecular do tipo AB2 podem apresentar essa geometria. Diferentemente do caso anterior, quando o átomo central possui um ou mais pares eletrônicos não ligantes, a molécula tende a sofrer uma curvatura devido ao efeito de repulsão entre os pares de elétrons.
Trigonal plana
Esse tipo de geometria pode ser encontrado em moléculas com fórmula AB3, na qual o átomo central não possui pares de elétrons não ligantes. Dessa forma, os átomos ligantes tendem a ficar afastados entre si ao máximo, minimizando os efeitos de repulsão. A configuração da molécula assume o formato de um triângulo.
Piramidal
Também é encontrada em compostos com fórmula AB3, porém, nesse caso, o átomo central possui um par eletrônico não ligante. Assim, o efeito de repulsão desse par eletrônico sobre aqueles que formam a ligação provoca uma curvatura no plano em que os átomos ligantes se encontram. O resultado é uma estrutura que se parece com uma pirâmide de base triangular.
Publicidade
Tetraédrica
Quando não há pares eletrônicos não ligantes ao redor do átomo central, moléculas do tipo AB4 podem apresentar geometria tetraédrica. Então, os átomos ligantes tendem a ficar distantes entre si. O resultado desse efeito é uma forma geométrica semelhante a um tetraédro.
Bipiramidal trigonal
Assim como o nome sugere, trata-se de uma conformação que se assemelha a uma figura formada por duas pirâmides unidas pela base, com formato triangular. Ela ocorre em compostos que apresentam fórmula do tipo AB5. Além disso, o átomo central não possui pares de elétrons não ligantes.
Octaédrica
É um tipo de geometria comum em espécies que apresentam fórmula molecular do tipo AB6. Assim como no caso anterior, a figura associada a essa geometria é um octaedro, que consiste em dois tetraedros unidos pela base.
Esses são os casos mais comuns de geometria molecular e descrevem o formato da maioria dos compostos químicos, mais especificamente daqueles formados por ligações de caráter covalente.
Exemplos de geometria molecular
Confira exemplos de geometria molecular relacionados aos compostos mais conhecidos, comparando as semelhanças e diferenças entre eles. É comum se deparar com esses casos em questões de vários concursos públicos ou provas de vestibular.
Dióxido de carbono (CO2)
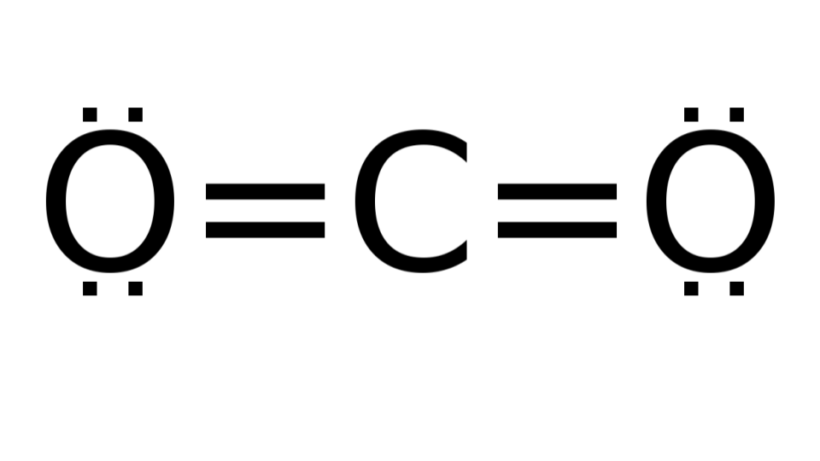
Consiste em uma molécula com fórmula do tipo AB2, na qual não há nenhum par eletrônico não ligante ao redor do átomo central (carbono). Por consequência, a molécula assume geometria linear.
Água (H2O)
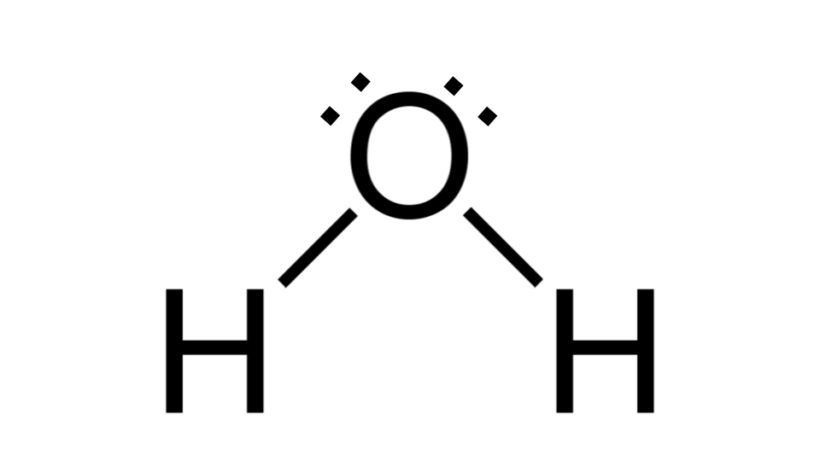
Assim como no caso anterior, a fórmula do composto é AB2, contudo a geometria dessa espécie não é linear, mas, sim, angular. O átomo de oxigênio possui dois pares de elétrons não ligantes, promovendo a repulsão entre pares ligantes e não ligantes, bem como curvando as ligações entre oxigênio e hidrogênio para baixo.
Sulfeto de hidrogênio (H2S)
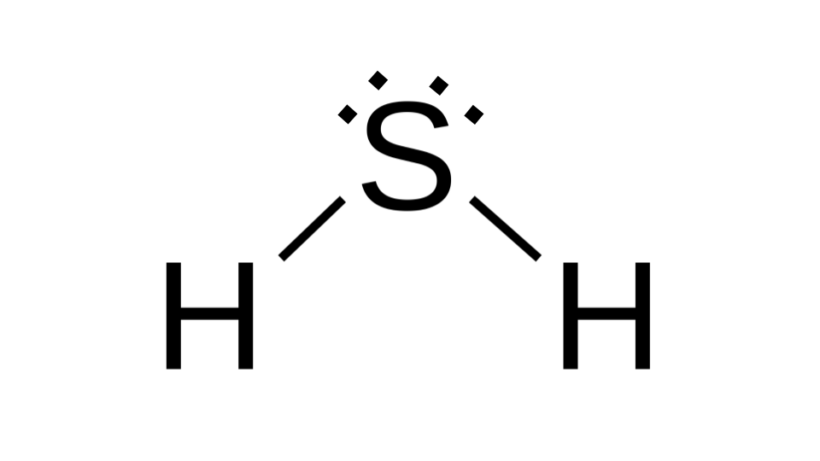
Também com fórmula do tipo AB2, o enxofre pertence a mesma família do oxigênio, ou seja, tem dois pares de elétrons não ligantes ao seu redor. Como consequência, o composto assume geometria angular.
Amônia (NH3)
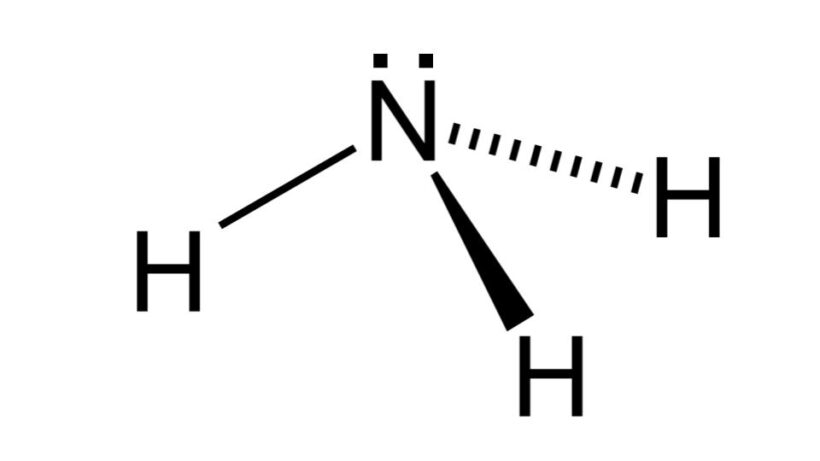
Com fórmula AB3, a molécula de amônia assume geometria piramidal, pois o átomo de nitrogênio possui um par de elétrons não ligante. Assim, força os pares de elétrons ligantes para baixo, resultando em algo parecido com uma pirâmide de base trigonal.
Metano (CH4)
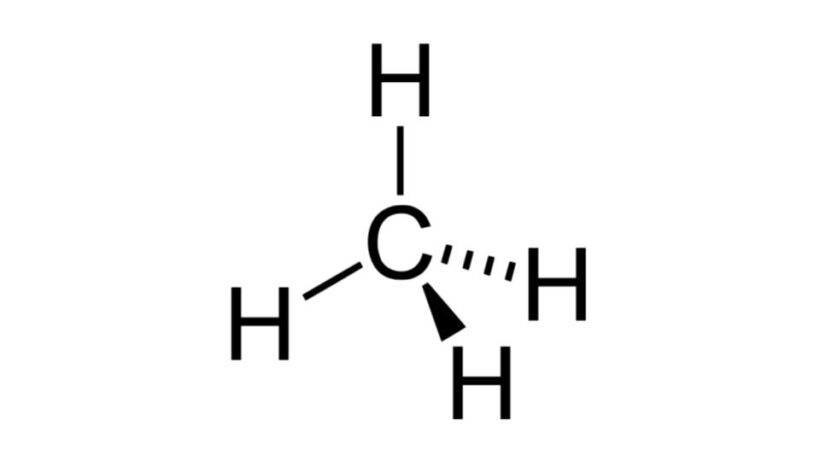
Um dos hidrocarbonetos mais simples, a molécula de metane possui fórmula do tipo AB4 e tem geometria tetraédrica. O átomo de carbono não contém pares de elétrons não ligantes, desse modo, os átomos de hidrogênio conseguem se organizarem para ficarem distantes entre si.
É comum encontrar um padrão entre os compostos, como no caso da água e do sulfeto de hidrogênio. Essa tendência é decorrente das propriedades periódicas dos elementos e ocorre quando os elementos pertencem à mesma família.
Vídeos sobre geometria molecular e como identificá-la
Para identificar a geometria que um composto pode assumir, é necessário conhecer outras características da molécula como a família e o período em que os átomos dessa estrutura se localizam na tabela periódica. Além disso, saber o tipo de ligação entre os átomos também contribui para elucidar a sua forma espacial. Abaixo confira uma seleção de videoaulas:
Pontos importantes sobre geometria molecular
Em uma aula bem descontraída, o professor apresenta um passo a passo para auxiliar a identificar a geometria dos compostos. Um destaque importante a ser feito é em relação à distribuição eletrônica do elemento, que pode ser determinada pela sua família.
Resumo: geometria molecular
Nessa aula, você aprenderá sobre a relação entre a matemática e a química por meio da geometria. Para discutir sobre a forma espacial das moléculas, usa-se a “teoria da repulsão das nuvens eletrônicas”. Acompanhe o vídeo!
Revisão sobre geometria molecular
Essa aula retoma e complementa tópicos estudados no decorrer da matéria, incluindo mais exemplos de compostos. O professor foca no conceito de nuvem eletrônica e a sua contribuição para a configuração da molécula.
O segredo para elucidar o arranjo de uma molécula consiste em analisar a quantidade de átomos que a formam e a quantidade de elétrons que circundam o átomo central. Aproveite para aprender sobre outras ligações químicas.
Referências
BURDGE, J.; OVERBY, J. Chemistry: atoms first. 3 ed. McGraw Hill, 2018. p. 247-251.
REIS, M. Química: ensino médio – volume 2. 2. ed. São Paulo: Ática, 2016. p. 235-6.
BROWN, T.L; LEMAY, H.E.; BURSTEN, B.E. Chemistry: the central science. 12 e. Prentice Hall, 2012. p. 333-340.

Por Ademar Vinicius Fagion Freitas
Graduando em Química pela Universidade Estadual de Maringá (UEM), com ênfase na área de ensino. Atua como professor de química no setor privado e como voluntário no Cursinho UEM. Curte ler, assistir filmes e séries nas horas vagas.
Fagion Freitas, Ademar Vinicius. Geometria molecular. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/geometria-molecular. Acesso em: 15 de February de 2026.
1. [Todo Estudo]
Certo composto com fórmula molecular AX3Y2 tem como átomo central a espécie A, na qual não há um par eletrônico não ligante sobre o átomo central e essa espécie realiza 5 ligações. Ambas as espécies X e Y realizam apenas uma ligação simples com o átomo A. Qual é o tipo de geometria apresentada pelo composto AX3Y2?
a) Hexaédrica.
b) Pentaédrica.
c) Trigonal plana.
d) Bipiramidal trigonal.
e) Tetraédrica.
Resposta: D
Justificativa: como a espécie A realiza apenas 5 ligações e a fórmula do composto contém 5 átomos ligados a A por meio de ligação simples, a fórmula do composto pode ser resumida em AB5.
A geometria associada a um composto com essa fórmula e sem pares de elétrons não ligantes ao redor do átomo central é bipiramidal trigonal.
2. [Todo Estudo]
A reação entre a amônia (NH3) e o íon H+ resulta no íon amônio (NH4+). Qual é a geometria molecular que o íon amônio apresenta?
a) Piramidal.
b) Tetraédrica.
c) Trigonal plana.
d) Angular.
e) Octaédrica.
Resposta: B
Justificativa: a geometria da molécula de amônia é do tipo piramidal, por haver um par de elétrons não ligantes sobre o átomo de nitrogênio, forçando os elétrons da ligação nitrogênio-hidrogênio para baixo. O arranjo dessa espécie será do tipo tetraédrico.
3. [Todo Estudo]
Uma das características das soluções aquosas ácidas é a presença de íons hidrônio (H3O+). A geometria que descreve o arranjo desse íon é:
a) Piramidal.
b) Angular.
c) Linear.
d) Trigonal plana.
e) Bipiramidal trigonal.
Resposta: A
O íon hidrônio é proveniente da reação entre uma molécula de água (H2O) com um íon H+. A molécula de água tem geometria angular, pois o átomo de oxigênio possui dois pares de elétrons não ligantes.
Um dos pares eletrônicos do átomo de oxigênio estabelece uma ligação com o íon H+, resultando em uma molécula piramidal.