O dióxido de carbono, também conhecido como gás carbônico, é o gás exalado na respiração de animais. É o principal responsável pelo efeito estufa, que causa o aumento gradativo da temperatura terrestre. É ainda, o composto essencial para a realização de fotossíntese pelas plantas. Saiba tudo sobre esse composto, suas aplicações, fontes emissoras e influência na saúde e na natureza.
Publicidade
O que é o dióxido de carbono
O dióxido de carbono é uma molécula de estrutura linear, constituído de dois átomos de oxigênio ao redor de um átomo de carbono, com ligações covalentes duplas entre cada átomo. Cada ligação é tida como polar, já que o átomo de O é mais eletronegativo do que o átomo de C, porém, como a molécula é simétrica e linear, ela acaba sendo apolar.
Relacionadas
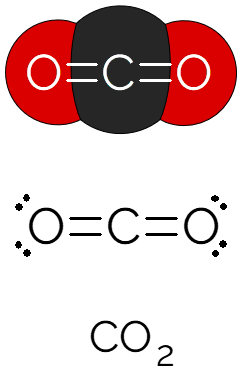
Devido à geometria e o caráter apolar da molécula, as interações intermoleculares são fracas entre as moléculas de CO2. Justamente por isso, ele é um gás em temperatura ambiente. É incolor e mais denso que o ar atmosférico. Presente na atmosfera da Terra, a camada de gás carbônico aprisiona o calor solar, sendo um dos principais responsáveis pelo efeito estufa.
Aplicações
Além de estar presente no processo de fotossíntese realizado pelas plantas, que faz com que tenhamos gás oxigênio para respirar, o dióxido de carbono é muito empregado em indústrias alimentícias, principalmente em bebidas gaseificadas, num processo chamado de carbonatação, em que o CO2 é adicionado aos líquidos para gaseificá-los.
Também é o componente principal de um tipo de extintor de incêndio indicado para apagar fogos de líquidos inflamáveis ou equipamentos eletrônicos (classes B e C) já que é um gás que isola e impede que o O2 do ar continue o processo de combustão. Além dessas, o dióxido de carbono tem aplicações em outros ramos da indústria, como para a síntese de compostos importantes na produção de fármacos e polímeros. Veja, a seguir, algumas das principais fontes de emissão do CO2.
Fontes emissoras
Existem muitas fontes emissoras de dióxido de carbono na atmosfera, como a respiração pulmonar de seres vivos. Apesar disso, o setor industrial é um dos que tem maior influência na poluição da atmosfera por emissão de CO2. Veja a seguir mais a fundo sobre essa e outras fontes emissoras.
Publicidade
Industrialização e queima de combustíveis
Desde a revolução industrial na segunda metade do Século XVIII, a concentração de dióxido de carbono na atmosfera tem aumentado. Isso se dá porque algumas indústrias realizam a queima de materiais, seja como parte da produção ou como fonte de calor para aquecimento, por exemplo. Essa queima, tem como produto o gás carbônico que é liberado na atmosfera. O mesmo acontece com a combustão de combustíveis, fósseis ou não, em automóveis, que libera o CO2 no ambiente.
Queimadas e desmatamento
As queimadas de florestas é outra fonte de emissão do dióxido de carbono, por conta da reação de combustão da matéria orgânica que acontece, tendo como produto CO2 e água.
Como já dito, desde a Revolução Industrial, a concentração de dióxido de carbono na atmosfera tem aumentado gradualmente. Além disso, problemas ambientais como o desmatamento e queimadas têm grande influência na emissão. Saiba, agora, quais são as consequências da presença de CO2 na atmosfera
Publicidade
Impactos na saúde e meio ambiente
O gás carbônico é um dos gases do efeito estufa (GEE). Ou seja, isso significa que ele tem influência no clima do planeta. Quanto mais CO2 presente na atmosfera, maior é a quantidade de calor retido. Consequentemente a temperatura terrestre tende a aumentar, ou seja, ocorre o aquecimento global. Além disso, ele pode se dissolver na chuva, deixando-a ácida, fator que pode prejudicar estruturas e desregular o pH do solo e do mar. No organismo humano, o CO2 pode diminuir o pH do sangue e causar asfixia e desmaios se for inalado em elevadas concentrações.
Vídeos sobre o dióxido de carbono
Agora que o conteúdo já foi apresentado, veja alguns vídeos que o ajudarão a assimilar melhor o tema estudado.
O que é o dióxido de carbono
Também chamado de gás carbônico, o CO2 é um composto que tem muita influência no efeito estufa, além de ser um dos principais substâncias da fotossíntese realizada pelas plantas. Saiba mais sobre esse gás tão presente na atmosfera, as principais fontes de emissão e os problemas envolvidos com o excesso de dióxido de carbono na terra.
Os perigos do dióxido de carbono
O gás carbônico é mais denso que o ar atmosférico. Recentemente, um grupo de pessoas jogou gelo seco, a forma sólida do dióxido de carbono, em uma piscina para que ela ficasse com aquela “fumaça”, que, na verdade, é constituída de água que condensou com a baixa temperatura do gelo. O problema foi que as pessoas se intoxicaram com o gás carbônico gerado da sublimação do gelo seco, causando uma acidose sanguínea. Saiba em detalhes como e porquê isso aconteceu com esse vídeo, com experiências para ajudar na explicação de tudo.
Gelo seco é dióxido de carbono congelado
Em condições normais de temperatura e pressão, o dióxido de carbono é um gás. Porém, quando ele é resfriado a temperaturas menores que -78 °C, ele passa para o estado sólido. Uma característica interessante desse sólido é que ele sublima à temperatura ambiente, ou seja, passa diretamente do estado sólido para o gasoso, pulando a etapa líquida. Veja algumas experiências interessantes com esse composto, além da resolução de exercícios cobrados em provas de vestibulares e ENEM, relacionadas com o conteúdo.
Em síntese, o dióxido de carbono é um gás importante para a manutenção da vida, sendo essencial para a realização de fotossíntese por plantas, que libera O2 para que os seres-vivos respirem. Por outro lado, quando em elevadas concentrações, é um dos principais responsáveis pelo aquecimento global. Não pare de estudar por aqui, veja também sobre a combustão, que libera CO2 quando for completa.
Referências
Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente (2005) – Peter Atkins e Loretta Jones
Química: a ciência central (1999) – Theodore L. Brown, Eugene H. LeMay, Bruce E. Bursten e Julia R. Burdge

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Dióxido de carbono. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/dioxido-de-carbono. Acesso em: 08 de February de 2026.
1. [ENEM 2020]
O dióxido de carbono passa para o estado sólido (gelo seco) a –78 °C e retorna ao estado gasoso à temperatura ambiente. O gás é facilmente solubilizado em água, capaz de absorver radiação infravermelha da superfície da terra e não conduz eletricidade.
Ele é utilizado como matéria-prima para a fotossíntese até o limite de saturação. Após a fixação pelos organismos autotróficos, o gás retorna ao meio ambiente pela respiração aeróbica, fermentação, decomposição ou por resíduos industriais, queima de combustíveis fósseis e queimadas. Apesar da sua importância ecológica, seu excesso causa perturbações no equilíbrio ambiental.
Considerando as propriedades descritas, o aumento atmosférico da substância afetará os organismos aquáticos em razão da
a) redução do potencial hidrogeniônico da água.
b) restrição da aerobiose pelo excesso de poluentes.
c) diminuição da emissão de oxigênio pelos autótrofos.
d) limitação de transferência de energia entre os seres vivos.
e) retração dos oceanos pelo congelamento do gás nos polos.
Como dito no enunciado, o CO2 se dissolve facilmente na água. Isso faz com que ocorram reações entre o gás carbônico dissolvido com moléculas de água. Essas reações têm como produto o ácido carbônico (H2CO3), como mostrado a seguir:
CO2 (aq) + H2O(l) ⇌ H2CO3 (aq)
O H2CO3, por sua vez, se dissocia em meio aquoso, formando duas espécies:
H2CO3 (aq) ⇌ H+(aq) + HCO3–(aq)
A presença de H+ faz com que o pH (potencial hidrogeniônico) do meio aquático seja diminuído, ou seja, se torna mais ácido. Sendo assim, a alternativa correta é a letra a) redução do potencial hidrogeniônico da água.
2. [UDESC - 2016/1]
O consumo cada vez maior de combustíveis fósseis tem levado a um aumento considerável da concentração de dióxido de carbono na atmosfera, o que acarreta diversos problemas, dentre eles o efeito estufa.
Com relação à molécula de dióxido de carbono, é correto afirmar que:
a) é apolar e apresenta ligações covalentes apolares.
b) é polar e apresenta ligações covalentes polares.
c) os dois átomos de oxigênio estão ligados entre si por meio de uma ligação covalente apolar.
d) é apolar e apresenta ligações covalentes polares.
e) apresenta quatro ligações covalentes apolares.
A molécula de dióxido de carbono é apolar, por conta se sua simetria linear. Porém, as ligações covalentes existentes entre cada átomo de oxigênio com o carbono são polares. Isso por conta da diferença de eletronegatividade entre os átomos de C e O. Novamente, como a molécula é linear, os dipólos se anulam, fazendo com que ela seja apolar. Sendo assim, a alternativa correta é a letra d) é apolar e apresenta ligações covalentes polares.