A oxirredução, também chamada de reação redox, abrange uma série de reações químicas importantes como a combustão, a fotossíntese, a corrosão, entre outras. Nela, ocorre a transferência de elétrons de uma espécie química para outra, ou seja, uma perde elétrons (sofre oxidação) e a outra ganha (sofre redução). A seguir, conheça mais sobre a reação e aprenda o balanceamento redox.
Publicidade
O que é a oxirredução
A oxirredução é uma reação cuja principal característica é a transferência de elétrons entre os átomos oxidados para os reduzidos. Um exemplo disso é visto na reação de zinco metálico com íons hidrogênio em solução aquosa:
Relacionadas
Zn(s) + 2H+(aq) → Zn2+(aq) + H2(g)
Nela, o zinco metálico perde dois elétrons, transferindo-os para o íon hidrogênio, ou seja, o zinco é oxidado a Zn2+, tem seu número de oxidação (NOX) aumentado de zero para 2+. Do mesmo modo, o H+ é reduzido a hidrogênio gasoso, então tem seu NOX diminuído de 1+ para 0.
- Oxidação: perda de elétrons por parte de uma espécie química, como resultado, ocorre o aumento do NOX dessa espécie.
- Redução: ganho de elétrons das espécies químicas. Nesse caso, como o elétron é uma carga negativa, ocorre a diminuição do NOX da espécie (seu valor reduz, comparado ao inicial)
As reações de oxirredução acontecem de maneira espontânea, ou seja, são termodinamicamente favoráveis. A transferência dos elétrons pode gerar energia na forma de calor, porém, em alguns casos, ocorre a produção de energia elétrica, como acontece com as pilhas.
Balanceamento por oxirredução
Uma característica interessante das reações de oxirredução é a possibilidade de fazer o balanceamento das equações químicas analisando as espécies que sofreram oxidação e redução. Para isso, um passo a passo nos ajuda a fazer o balanceamento:
Publicidade
- 1º Passo: determinar o NOX de todos os átomos das espécies químicas envolvidas;
- 2º Passo: calcular o ΔNOX = NOXmaior – NOXmenor das espécies que oxidaram e reduziram;
- 3º Passo: atribuir o resultado do ΔNOXoxidação para o número de átomos da espécie que reduz.
- 4º Passo: atribuir o resultado do ΔNOXredução para o número de átomos da espécie que oxidaram;
- 5º Passo: completar com as tentativas para atingir o balanceamento de todas as espécies envolvidas.
Dessa forma o balanceamento da equação pode ser facilmente calculado. Nas etapas 3 e 4 é preciso considerar a quantidade de elétrons envolvidos conforme o índice dos elementos que oxidaram ou reduziram para determinar o coeficiente das espécies opostas.
Exemplos de oxirredução
Confira alguns exemplos para aprender na prática como é feito um balanceamento por oxirredução. Acompanhe:
Reação de permanganato de potássio com ácido clorídrico
O permanganato de potássio (KMnO4) com o HCl formam uma reação de oxirredução que dá origem a 4 produtos, como mostrado pela reação (não-balanceada):
Publicidade
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
Seguindo os passos descritos anteriormente, o balanceamento fica da seguinte forma:
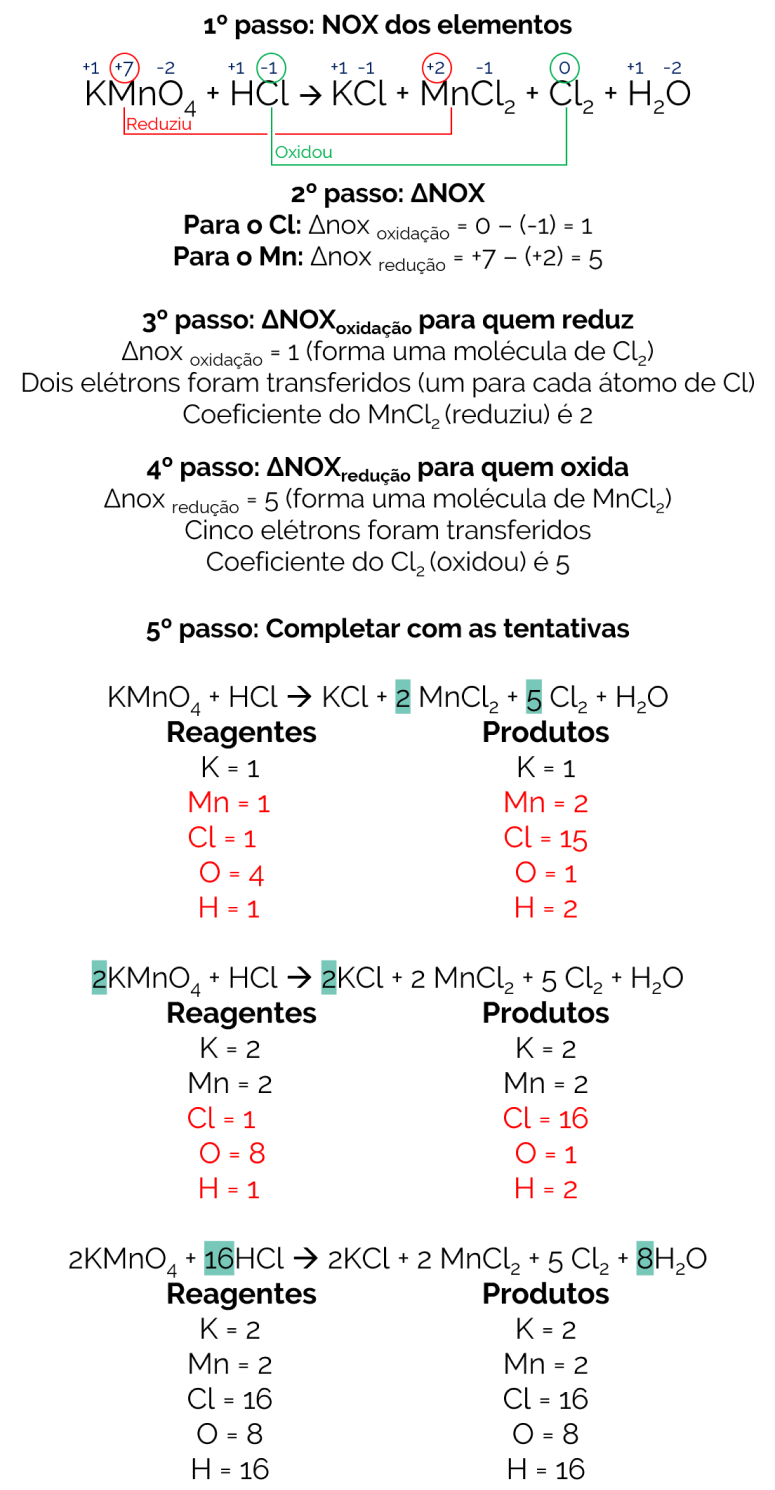
Portanto a equação balanceada é:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Reação de produção de gás metano
Em 1856, Berthelot propôs uma reação para produção de gás metano a partir da redução de dissulfeto de carbono (CS2) com cobre metálico:
CS2 + H2S + Cu → CH4 + Cu2S
O balanceamento dessa reação fica:
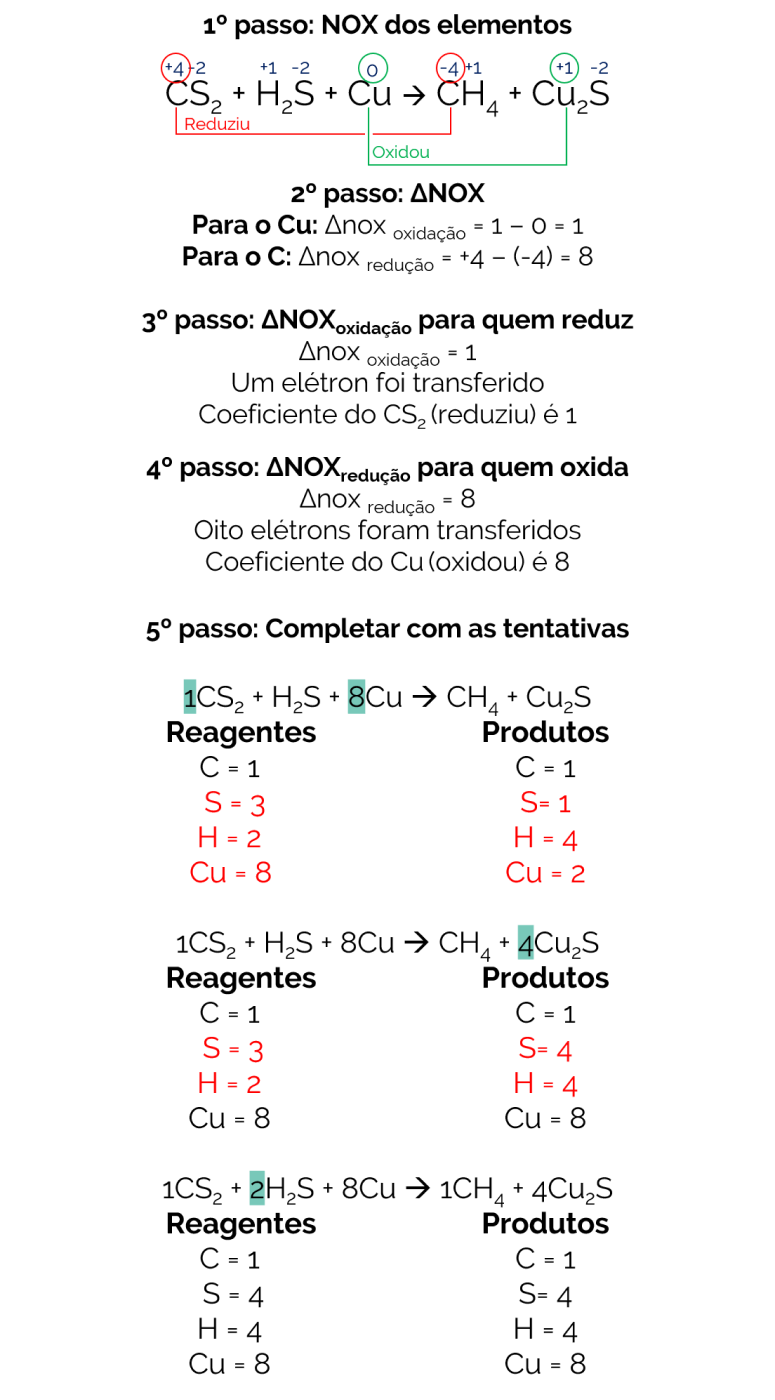
Portanto, a reação balanceada é:
1CS2 + 2H2S + 8Cu → 1CH4 + 4Cu2S
Realizar o balanceamento dos coeficientes estequiométricos de reações redox é muito prático, além disso, é mais rápido que outros métodos como o da tentativa e erro. Seja como for, a resolução de exercícios é importante para dominar o balanceamento de oxirredução.
Vídeos sobre as reações de oxirredução
Para ampliar seus conhecimentos e compreender melhor o conteúdo estudado, veja alguns vídeos sobre o assunto. Confira:
Características das reações redox
As reações redox, como são chamadas as reações de oxirredução, são importantes em diversos processos químicos presenciados no cotidiano, desde a fotossíntese até a ferrugem que se forma em uma barra de ferro exposta ao ar livre. Saiba mais sobre esse tipo de reação e veja alguns exemplos de cálculo do NOX das espécies químicas.
Como fazer balanceamento químico por oxirredução
O balanceamento por oxirredução é uma técnica para cálculo de coeficiente estequiométrico muito prática e economiza bastante tempo, se comparada ao método da tentativa e erro. Veja alguns exercícios resolvidos de questões de vestibulares sobre esse tipo de balanceamento.
Experiência de oxirredução com violeta
Uma maneira visual de acompanhar uma reação redox é por uma experiência que consome a cor violeta de uma solução. Nela o permanganato de potássio KMnO4 reage com a água-oxigenada (H2O2) em meio ácido (por conta do vinagre). Dessa forma, ocorre a descoloração da solução, além da liberação de gás oxigênio. O manganês reduz e o oxigênio oxida. Assista ao vídeo para conferir.
Enfim, a oxirredução é uma reação química em que acontece a transferência de elétrons de uma espécie para outra, fazendo com que uma seja a espécie oxidada e outra a reduzida. Saiba mais sobre o número de oxidação, visto que é útil na hora de fazer o balanceamento redox.
Referências
Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente (2005) – Peter Atkins e Loretta Jones
Química: a ciência central (1999) – Theodore L. Brown, Eugene H. LeMay, Bruce E. Bursten e Julia R. Burdge
Fundamentos de Química Analítica (1963) – Douglas A. Skoog, Donald M. West, F. James Holler e Stanley R. Crouch
Química Analítica (1971) – Gary D. Christian

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Oxirredução. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/oxirreducao. Acesso em: 28 de January de 2026.
1. [CESGRANRIO-RS]
Observe a reação:
SnCl2 + 2 HCl + H2O2 → SnCl4 + 2 H2O.
A partir dela, podemos afirmar corretamente que:
a) o Sn e o Cl sofrem oxidação.
b) o Sn sofre oxidação, e o O, redução.
c) o Sn sofre oxidação, e HCl, redução.
d) a H2O2 sofre redução, e o Cl, oxidação.
e) a H2O2 sofre oxidação, e o Sn, redução.
Analisando a reação e atribuindo os valores de NOX para cada elemento da reação:
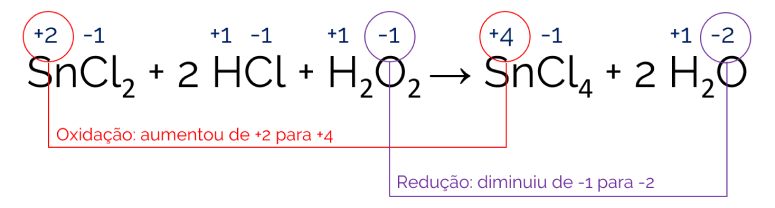
O estanho (Sn) sofreu um processo de oxidação, uma vez que seu NOX passou de +2 para +4. Já o oxigênio (O) teve seu NOX diminuído de -1 para -2, ou seja, sofreu uma redução. Portanto a alternativa correta é a letra B.
2. [Ufjf - 2018]
O vanádio, não combinado com outros elementos, não á encontrado naturalmente, porém está presente em diferentes minerais e é um elemento essencial em alguns organismos. Para a obtenção do vanádio, pode-se utilizar a aluminotermia que consiste em aquecer o óxido de vanádio misturado com alumínio em pó, de acordo com a equação da reação a seguir:
xV2O5(s) + yAl(s) → zV(s) + wAl2O
Onde x, y, z, e w são os coeficientes estequiométricos.
Sobre essa reação assinale a alternativa CORRETA:
a) O pentóxido de vanádio sofreu oxidação.
b) x e y são iguais.
c) O agente redutor é o óxido de alumínio.
d) z + 4 = y
e) x + z = w
Realizando os primeiros passos do balanceamento (determinar o NOX dos elementos e calcular os ΔNOX das reações de oxidação e redução:
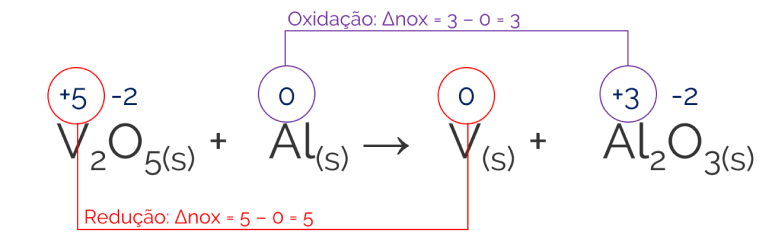
Em seguida, sabemos que:

Dessa forma a alternativa correta é a letra d, pois, explicando todas:
a. Pela reação percebemos que o pentóxido de vanádio reduziu.
b. X = 3 e y = 10
c. O agente redutor (quem sofre oxidação) é, na verdade, o alumínio (Al(s))
d. Z = 6; y = 10. Z + 4 = y → 6 + 4 = 10
e. X = 3; z = 6; w = 5. → 3 + 6 ≠ 5