Quando um vapor está em equilíbrio termodinâmico com o líquido que o originou, há uma pressão sobre o líquido. Essa pressão é a pressão de vapor. Nesse texto, você entenderá sobre seu funcionamento e sua fórmula, além de conferir videoaulas e exercícios resolvidos sobre o assunto. Acompanhe:
Publicidade
O que é a pressão de vapor
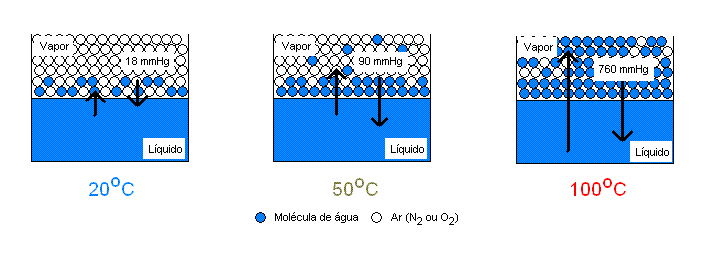
De maneira resumida, a pressão de vapor é uma medida para a tendência à evaporação de um líquido. Além disso, é uma grandeza física que varia conforme a temperatura do líquido. Quanto maior for a sua temperatura, desde que seja menor que a temperatura de ebulição, maior será a evaporação.
Relacionadas
Quanto maior for a pressão de vapor de um líquido, mais volátil ele será. Ou seja, líquidos com maiores pressões de vapor evaporam com mais facilidade.
Fórmula da pressão de vapor
A fórmula da pressão de vapor também é conhecida como Lei de Raoult. Segundo ela, a pressão de vapor máxima de uma solução deve ser igual a uma fração molar do solvente multiplicado pela pressão de vapor máxima do solvente. Matematicamente:
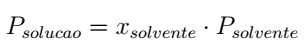
Em que,
Publicidade
- Psolução: pressão de vapor máxima da solução (Pa).
- Psolvente: pressão de vapor máxima do solvente (Pa).
- xsolvente: fração molar do solvente.
Note que a fração molar do solvente é dada pela razão entre o número de mols do solvente e a soma do número de mols do solvente e do soluto.
Por se tratar de uma razão, essa grandeza é adimensional, enquanto as pressões de vapor do solvente e da solução, no sistema internacional de unidades, são medidas em Pascal. De maneira usual, a pressão de vapor pode ser medida em atmosferas (atm) ou em milímetros de mercúrio (mmHg).
Vídeos sobre pressão de vapor
A seguir, assista aos vídeos selecionados para aprofundar ainda mais seus conhecimentos sobre o assunto:
Publicidade
Pressão de vapor e tonometria
Nesse vídeo do canal Café com Química, você aprende as relações entre pressão de vapor e temperatura, pressão de vapor e volatilidade e, também, a relação entre pressão de vapor e ligações intermoleculares. Por fim, ainda entende o que é tonometria.
Pressão de vapor e pressão total
O professor Jorge Sá Martins resolve exercícios sobre potenciais termodinâmicos e, para isso, utiliza os conceitos de pressão de vapor e pressão total sobre uma substância em equilíbrio termodinâmico.
Química e pressão de vapor
Aprofunde seus conhecimentos sobre a relação da química com a pressão de vapor. Para isso, assista à aula do professor Batata. Além disso, nesse vídeo, você também entenderá como representá-la graficamente.
Para entender como a pressão de vapor interage com as substâncias, compreenda também a relação entre soluto e solvente!
Referências
Física II: termodinâmica e ondas (2016) – Hugh d. Young et al
Química: a ciência central (2008) – Theodore Brown

Por Hugo Shigueo Tanaka
Divulgador Científico e co-fundador do canal do YouTube Ciência em Si. Historiador da Ciência. Professor de Física e Matemática. Licenciado em Física pela Universidade Estadual de Maringá (UEM). Mestre em Ensino de Ciências e Matemática (PCM-UEM). Doutorando em Ensino de Ciências e Matemática (PCM-UEM).
Tanaka, Hugo Shigueo. Pressão de vapor. Todo Estudo. Disponível em: https://www.todoestudo.com.br/fisica/pressao-de-vapor. Acesso em: 20 de February de 2026.
1. [UEG]
As propriedades físicas dos líquidos podem ser comparadas a partir de um gráfico de pressão de vapor em função da temperatura, como mostrado no gráfico hipotético a seguir para as substâncias A, B, C e D.
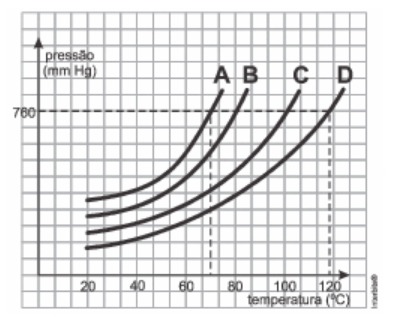
Segundo o gráfico, o líquido mais volátil será a substância:
a) A
b) B
c) C
d) D
Comparando os quatro líquidos entre si a partir das curvas de vaporização, é possível notar que, para uma temperatura fixa, o líquido A apresenta maior pressão de vapor. Dessa forma, ele será o mais volátil.
Alternativa correta: A
2. [UFU]
O estudo das propriedades coligativas das soluções nos permite prever as alterações nas propriedades de seu solvente.
A respeito das propriedades coligativas, assinale a alternativa correta.
a) Se for colocada água com glutamato de monossódio dissolvido para congelar em uma geladeira, a temperatura de fusão da água na solução permanecerá a mesma que a da água pura.
b) As propriedades coligativas independem do número de partículas do soluto na solução, da natureza das partículas e de sua volatilidade.
c) Se forem preparadas duas soluções aquosas de mesma concentração, uma de glutamato monossódio e outra de açúcar, a temperatura de ebulição da água na solução será maior que a água na solução de açúcar.
d) Em uma panela tampada, a pressão de vapor da solução aquosa de glutamato de monossódio é maior do que a pressão de vapor da água pura porque a presença do sal facilita a evaporação do solvente.
O glutamato de monossódio sofre dissociação gerando duas partículas em solução: íon glutamato e íon de sódio. Já o açúcar não sofre dissociação e nem ionização.
O efeito coligativo é proporcional ao número de partículas não-voláteis presentes no meio, então a solução de glutamato de monossódio provocará um aumento na temperatura de ebulição maior que o aumento gerado por uma solução de açúcar de mesma concentração.
Alternativa correta: C