A regra do octeto, também definida como teoria do octeto, abrange a necessidade de átomos possuírem oito elétrons em sua camada de valência. O número em questão geraria a estabilidade química do elemento em questão.
Publicidade
Assim, o que diz a Regra do Octeto:
“[…] estabelece-se que, em uma ligação química, um átomo tende a ficar com oito elétrons em sua camada de valência no estado fundamental, semelhante a um gás nobre.”
Para atingir a estabilidade química, e, consequentemente, apresentar os oito elétrons na camada de valência, ligações químicas são necessárias. Elas serão as responsáveis por receber, ceder ou compartilhar elétron.
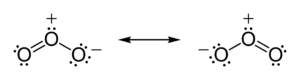
A tendência dos átomos é compartilhamento de elétrons até que adquiram a estabilidade. Sendo assim, até que a camada de valência atinja a completude química.
Por meio disso, o átomo apresentará distribuição de elétrons similar a um gás nobre (que conta com estabilidade natural) mais próximo ao seu número atômico.
Oriundos da Família 8A, os gases nobres são os elementos oriundos da tabela periódica que apresentam oito elétrons na camada de valência. A este caso, a única exceção é o Hélio, um gás que apresenta apenas dois elétrons na camada de valência.
Publicidade
Entretanto, é importante ressaltar que o Hélio alcança sua estabilidade química com estes dois elétrons. O Hélio e os demais gases, assim, já são naturalmente adequados à regra do octeto.
Quando um elemento apresenta oito elétrons na camada de valência, ele está estável quimicamente. Ou seja, ele não se ligará com os demais átomos, por não perde ou ganhar elétrons.
É por esse motivo que não existem ligações químicas envolvendo gases nobres.
Publicidade
Exemplos de Regra do Octeto
Dois exemplos para exemplificar a regra do octeto são o Cloro e o Oxigênio. Sendo assim, temos:
- Cloro: com número atômico 17 e sete elétrons na camada de valência. Para formar a molécula Cl2, há um compartilhamento de elétrons para alcançar a estabilidade.
- Oxigênio: conta com seis elétrons na camada de valência. A fim e alcançar a estabilidade, ele precisará receber dois elétrons a fim de atingir a estabilidade. Exemplo disso é a ligação com hidrogênio, formando a água.
Exceções da regra do octeto
Em toda a regra, a exceção existe. Na Teoria do Octeto não é diferente. Assim, teremos duas pontuais exceções à regra.
Elementos estáveis com menos de oito elétrons: trata-se da chamada contração do octeto. Neste, elementos atingiriam a estabilidade com menor número de elétrons do que oito. O Boro (B) e o Alumínio (Al), por exemplo, tornam-se estáveis com apenas seis elétrons na camada de valência.
Estáveis com mais de oito elétrons: trata-se da chamada expansão do octeto. Nele, elementos alcançarão a estabilidade sobrepondo os oito elétrons da camada de valência. São exemplos o Fósforo (P) e o Enxofre (S), que podem receber até 10 e 12 elétrons, respectivamente.
Referências
SALVADOR, Edgard e USBERCO, João. Química, volume único. 1ª edição, Editora Saraiva, São Paulo-SP, 2006. 672 p.

Por Mateus Bunde
Graduado em Jornalismo pela Universidade Federal de Pelotas (UFPel), Especialista em Linguagens pelo Instituto Federal Sul-Rio-Grandense (IFSul) e Mestrando em Comunicação pela Universidade do Porto, de Portugal (UP/PT).
Bunde, Mateus. Regra do Octeto. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/regra-do-octeto. Acesso em: 29 de January de 2026.
01. [MACK] Para que átomos de enxofre e potássio adquiram configuração eletrônica igual à de um gás nobre, é necessário que:
(Dados: número atômico S = 16; K = 19).
a) o enxofre receba 2 elétrons e que o potássio receba 7 elétrons.
b) o enxofre ceda 6 elétrons e que o potássio receba 7 elétrons.
c) o enxofre ceda 2 elétrons e que o potássio ceda 1 elétron.
d) o enxofre receba 6 elétrons e que o potássio ceda 1 elétron.
e) o enxofre receba 2 elétrons e que o potássio ceda 1 elétron.
02. [Universidade Dom Bosco] Um elemento de configuração 1s2 2s2 2p6 3s23p5 possui forte tendência para:
a) perder 5 elétrons.
b) perder 1 elétron.
c) perder 2 elétrons.
d) ganhar 2 elétrons.
e) ganhar 1 elétron.
01. [E]
02. [E]