As propriedades coligativas surgem ao adicionar solutos não-voláteis em líquidos puros. Existem quatro efeitos: tonoscopia, ebulioscopia, crioscopia e osmocopia. Cada um deles trata da alteração de uma propriedade física dos líquidos, como pressão de vapor, pontos de ebulição ou fusão e pressão osmótica. Entenda como esses efeitos ocorrem e veja exemplos no cotidiano.
Publicidade
O que são as propriedades coligativas
As propriedades ou efeitos coligativos são as propriedades físicas de soluções que se alteram, quando comparadas com o solvente puro, conforme a adição de um soluto não-volátil. Essa alteração não depende da natureza do soluto, ou seja, ele pode ser um sal iônico como o cloreto de sódio (NaCl), ou um soluto molecular como o açúcar. Além disso, a intensidade dos efeitos coligativos depende da quantidade de partículas do soluto em solução.
Relacionadas
Como as propriedades coligativas não dependem da natureza do soluto, 1 mol de NaCl ou 1 mol de açúcar (sacarose) que for adicionada em água, provocará a mesma uma alteração em intensidade idêntica. O motivo é que nos dois casos há a mesma quantidade de molécula de soluto na água, 1 mol de partículas em solução.
Quais são as propriedades coligativas
Existem quatro efeitos coligativos que alteram as propriedades físicas de líquidos. São a tonoscopia, ebulioscopia, crioscopia e osmocopia. Cada um deles diz respeito a uma propriedade física dos líquidos que se altera. Portanto, veja com mais detalhes cada propriedade e como ela pode alterar características das soluções.
Tonoscopia
A tonoscopia avalia o abaixamento da pressão de vapor de um líquido após a adição de solutos não-voláteis. Esse aditivo interage com as moléculas do líquido e acaba estabilizando a solução, ou seja, diminui a capacidade de evaporação do solvente. Como consequência, a pressão de vapor sofre uma diminuição.
É observada ao comparar a evaporação de duas soluções, uma de água pura e outra de uma mistura de água com açúcar, que é um soluto molecular que se dissolve em meio aquoso. A solução doce levará mais tempo para evaporar, nas mesmas condições que o líquido puro, por conta do efeito tonoscópico.
Publicidade
Ebulioscopia
O foco da ebulioscopia é o aumento da temperatura de ebulição de um líquido após a adição do soluto. O modo com que esse aumento acontece é semelhante ao caso da tonoscopia. Dessa forma, como as moléculas estão mais estáveis em solução, a temperatura necessária para que ela entre em ebulição é maior.
Um exemplo observado no cotidiano é na fervura de água para cozimento de macarrão. Ao jogar sal, a água para de ferver, visto que sua temperatura de ebulição passará a ser maior que 100 °C (ao nível do mar).
Crioscopia
A crioscopia é o oposto do efeito ebulioscópico. Nela, ocorre um abaixamento da temperatura de fusão dos líquidos. Os solutos interagem com as moléculas dos líquidos dificultando a passagem do estado líquido para o sólido, portanto a temperatura para solidificação desse líquido passa a ser menor.
Publicidade
Uma técnica bem conhecida para gelar latinhas de bebida rapidamente é a de adicionar certa quantidade de sal em uma caixa térmica cheia de gelo. O sal faz com que a água se mantenha líquida a uma temperatura bem abaixo de 0 °C. Como o líquido cobre toda a superfície das latas, elas são resfriadas mais rapidamente. Outro exemplo é o de derretimento do gelo nas ruas de países frios, também pela adição de sal, para evitar acidentes.
Osmocopia
Nessa propriedade, ocorre a variação da pressão osmótica da solução, pressão mínima que precisa ser aplicada em uma solução para evitar o processo de osmose. Essa, por outro lado, é o fluxo de solvente de um meio menos concentrado para um mais concentrado através de uma membrana semipermeável. Portanto, a adição do soluto faz com que a pressão osmótica seja maior, para conter o solvente em seu ambiente de origem.
Essa propriedade é observada na desidratação de saladas. É muito comum fazer esse processo pela adição de elevadas quantidades de sal às folhas verdes. Após um tempo elas murcham, porque a água que estava em seu interior (meio menos concentrado) passa para o lado de fora (meio mais concentrado) pelo processo de osmose.
Definitivamente, as propriedades coligativas estão bem presentes no cotidiano, na maioria das vezes na culinária. O conhecimento, mesmo que básico, delas pode otimizar muito todos os processos culinários, como é o caso da fervura de água para cozimento, por exemplo. Adicionar o sal no início só faz com que a água leve mais tempo para ferver.
Segue abaixo o textinho para ser adicionado com a imagem:
Mapa mental
Para simplificar as informações e te ajudar no entendimento do tema, veja abaixo um mapa mental sobre as propriedades coligativas:
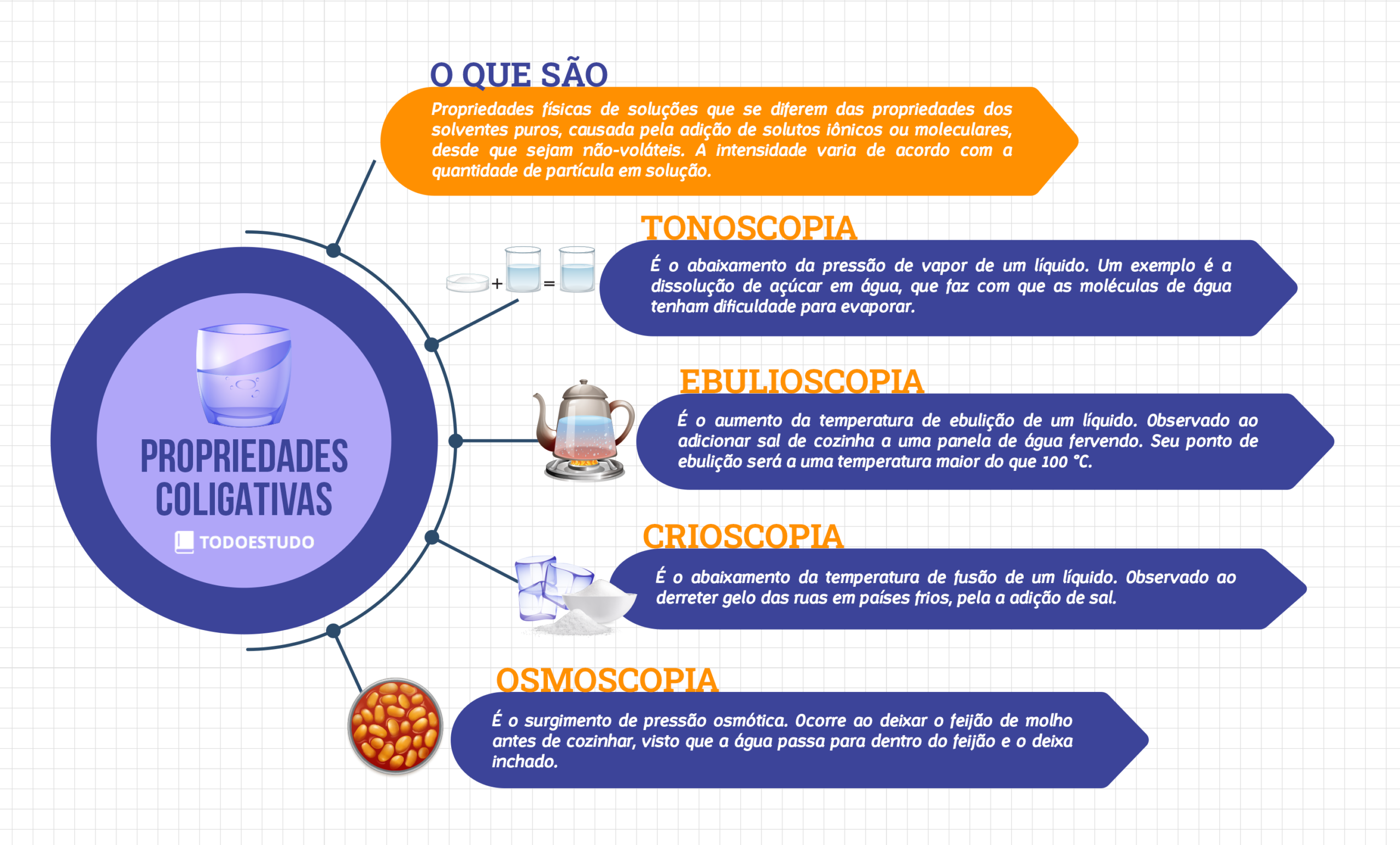
Consulte o mapa mental sempre que sentir necessidade, seja para tirar dúvida ou na hora de fazer uma revisão. Dessa forma, fica fácil lembrar as principais informações sobre as quatro propriedades coligativas.
Vídeos sobre as quatro propriedades coligativas
Agora que o conteúdo já foi abordado, veja alguns vídeos selecionados para auxiliar no entendimento do tema de estudo,
Os efeitos coligativos e suas definições
As propriedades coligativas são propriedades do solvente que se modificam na presença de um soluto não-volátil. Ela depende exclusivamente da quantidade de partículas que são adicionadas ao líquido, ou seja, não depende da natureza desse soluto. Entenda mais sobre esses efeitos e veja exemplos de cada uma das quatro propriedades.
A osmose é uma das propriedades coligativas
Entenda mais sobre a variação de pressão osmótica pela osmocopia, uma das propriedades coligativas. A osmose é a passagem de solvente de um meio menos concentrado para outro mais concentrado. Com essa revisão completa sobre todos os termos que dizem respeito à osmose, veja como essa propriedade funciona e resolva um exercício do ENEM sobre esse fenômeno.
Uma abordagem matemática para os efeitos coligativos
É possível calcular a dimensão da mudança das propriedades coligativas provocada pela adição de solutos em líquidos. Veja alguns exemplos de exercícios sobre as propriedades de ebulioscopia e crioscopia, entendendo como que o fenômeno acontece e calcule o modo como a temperatura de ebulição ou de fusão muda ao adicionar determinadas quantidades de solutos em líquidos.
Em síntese, as propriedades coligativas são mudanças que ocorrem nos líquidos provocadas pela adição de solutos não-voláteis, moleculares ou iônicos. São classificadas em tonoscopia, ebulioscopia, crioscopia e osmocopia. Não pare de estudar por aqui, veja mais sobre transformações físico-químicas de gases, como a transformação isocórica.
Referências
Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente (2005) – Peter Atkins e Loretta Jones
Química: a ciência central (1999) – Theodore L. Brown, Eugene H. LeMay, Bruce E. Bursten e Julia R. Burdge
Fundamentos de Físico-Química (1986) – Gilbert Castellan
Physical Chemistry (1978) – Ira N. Levine

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Propriedades coligativas. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/propriedades-coligativas. Acesso em: 04 de February de 2026.
1. [Cesgranrio-RJ ]
Determinou-se o ponto de fusão de uma substância x, encontrando-se um valor menor que o tabelado para essa substância. Isso pode significar que:
a) a quantidade de substância utilizada na determinação foi menor que o necessário.
b) a quantidade de substância utilizada na determinação foi maior que o necessário.
c) uma parte da substância não fundiu.
d) a substância contém impurezas.
e) a substância está 100% pura.
Como a temperatura de fusão foi menor que o valor tabelado, ou seja, valores estudados para os líquidos puros, ocorre um processo de crioscopia. Dessa forma, a solução da substância x continha algum soluto que diminuiu sua temperatura de fusão. A alternativa correta é a letra d) a substância contém impurezas.
2. [UFPE]
Por que a adição de certos aditivos na água dos radiadores de carros evita que ocorra o superaquecimento da mesma e também o seu congelamento, quando comparada com a da água pura?
a) Porque a água mais o aditivo formam uma solução que apresenta pontos de ebulição e de fusão maiores que os da água pura.
b) Porque a solução formada (água + aditivo) apresenta pressão de vapor maior que a água pura, o que causa um aumento no ponto de ebulição e de fusão.
c) Porque o aditivo reage com a superfície metálica do radiador, que passa então a absorver energia mais eficientemente, diminuindo, portanto, os pontos de ebulição e de fusão quando comparados com a água pura.
d) Porque o aditivo diminui a pressão de vapor da solução formada com relação à água pura, causando um aumento do ponto de ebulição e uma diminuição do ponto de fusão.
e) Porque o aditivo diminui a capacidade calorífica da água, causando uma diminuição do ponto de fusão e de ebulição.
O soluto adicionado provoca os efeitos das propriedades coligativas que são o abaixamento da pressão de vapor, aumento da temperatura de ebulição, diminuição da temperatura de fusão e aumento da pressão osmótica. Nesse sentido, nos radiadores de carros, o superaquecimento, que é a ebulição do líquido do radiador, não ocorre, pois sua temperatura de ebulição passa a ser maior. De modo oposto, o congelamento não existe porque a temperatura de fusão é menor que a da água pura. Sendo assim, a alternativa correta é a d) Porque o aditivo diminui a pressão de vapor da solução formada com relação à água pura, causando um aumento do ponto de ebulição e uma diminuição do ponto de fusão.