A concentração molar (em mol/L) é usada para determinar a quantidade de um determinado soluto em solução, assim como a concentração em g/L. Contudo, a relação de mol/L é a mais utilizada, visto que é a unidade de concentração do Sistema Internacional de Unidades (SI). Aprenda o conceito e como calcular a concentração molar.
Publicidade
O que é concentração molar
Popularmente chamada de molaridade, a concentração molar (M) é a razão entre a quantidade de matéria de um soluto (em mol) e o volume de solução (em litros). Sendo assim, é expressa em mol/L. É utilizado “mol” como quantidade, ao invés de massa em gramas, por exemplo, para universalizar e padronizar as unidades de medida e facilitar na hora de fazer cálculos.
Relacionadas
Ao considerar uma solução aquosa de 0,1 mol/L de hidróxido de sódio (NaOH), por exemplo, significa dizer que para cada litro de solução, existe 0,1 mol de NaOH dissolvido. Por seu conceito, um mol equivale a 6,022 x 1023 entidades elementares, sendo assim, um litro dessa solução possui cerca de 60 sextilhões de moléculas de NaOH dissolvidas em água.
Fórmula da concentração molar
O cálculo de concentração molar é feito pela equação que relaciona a quantidade de matéria (número de mol) do soluto e o volume de solução, representado abaixo como Equação 1. Por outro lado, quando não se conhece o número de mol da substância, mas sim sua massa e fórmula química, é possível utilizar a segunda equação para o cálculo
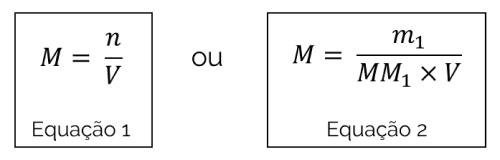
- M: concentração molar (em mol/L)
- n: quantidade de matéria (em mol)
- V: volume de solução (em litros)
- m1: massa do soluto (em gramas)
- MM1: massa molar da substância, obtida pela soma do número de massa de cada elemento que constitui o soluto (em g/mol)
A segunda equação é mais utilizada em questões de vestibulares, visto que no enunciado os dados fornecidos tem relação com a massa de determinada substância que foi utilizada para preparar uma solução. Veja, a seguir, como realizar esse tipo de cálculo.
Como calcular a concentração molar
Veja dois exemplos de como realizar o cálculo de molaridade de soluções.
Publicidade
Exemplo 1
Para calcular a concentração molar de uma solução, caso o número de mol do soluto já tiver sido fornecido, basta apenas substituir os valores na equação 1, apresentada acima, e calcular M. É importante se certificar de que o volume de solução já está em litros. Se for apresentado um volume em mL, por exemplo, a conversão é feita dividindo o valor por 1000 para obter a V em litros.
Questão: Qual é a concentração de uma solução de ácido clorídrico (HCl) sabendo que nela há 0,5 mol de soluto em 250 mL de solução?
Resolução: o valor de n é igual a 0,5 mol. Porém, como o volume não está em litro, é preciso converter o valor
Publicidade
V = 250 mL = 250 ÷ 1000 = 0,25L
Aplicando os valores na equação:
M = n
V
M = 0,5
0,25
M = 2,0 mol/L
Exemplo 2
Já no segundo caso, quando é fornecido apenas a massa de soluto que foi utilizada e o volume de solução, a segunda equação é utilizada. Dessa vez, é preciso olhar em uma tabela periódica os números de massa dos elementos para calcular a massa molar (MM) da substância.
Questão: Qual a concentração molar (M) de uma solução cujo volume é 0,350 L e contém 73,5 g de bicarbonato de sódio (NaHCO3)?
Resolução: O cálculo da MM do soluto (bicarbonato de sódio) é feito da seguinte forma:
Na = 23 u
H = 1 u
C = 12 u
O = 16 u
MMNaHCO3 = 23 + 1 + 12 + (3×16) = 84 g/mol
Os valores de massa e volume já estão no formato ideal, então basta aplicar na equação:
M = m1
MMNaHCO3.V
M = 73,5
84 . 0,350
M = 73,5
29,4
M = 2,5 mol/L
Vídeos sobre a concentração molar de soluções
Agora que o conteúdo já foi apresentado, veja alguns vídeos relacionados que foram escolhidos para ajudar a assimilar a matéria.
Conceito de molaridade
Molaridade e concentração em mol/L são sinônimos. Significa a quantidade de matéria de determinado soluto que está presente em um volume de solução. O cálculo é feito por uma equação matemática que relaciona essas duas grandezas. Veja em mais detalhes tudo sobre esse conteúdo, muito cobrado em vestibulares de todo o Brasil.
Modos de calcular a concentração molar
Existem duas maneiras de calcular a concentração de soluções. Quando é informado a quantidade de matéria do soluto ou quando é informado apenas a massa da substância que foi utilizada no preparo de uma solução. Veja o passo a passo de como realizar os cálculos. Além disso, aprenda também a como chegar na resposta sem precisar decorar a equação, fazendo o cálculo por regra de três.
Exercício de cálculo de molaridade
Veja esse exercício resolvido de cálculo de concentrações. Com ele, aprenda o passo a passo para nunca mais errar nas contas. É uma dúvida muito recorrente e, por ser um tema muito comum em vestibulares e exames como o ENEM, sempre é bom praticar com a resolução de exercícios.
Em síntese, a quantidade de matéria de determinada substância que está presente em um litro de solução é chamada de concentração molar, com unidade de medida de mol/L. É a unidade de concentração universal, utilizada em laboratórios, indústrias e cálculos. Não pare de estudar por aqui, veja também sobre cálculos estequiométricos.
Referências
Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente (2005) – Peter Atkins e Loretta Jones
Química: a ciência central (1999) – Theodore L. Brown, Eugene H. LeMay, Bruce E. Bursten e Julia R. Burdge
Fundamentos de Química Analítica (1963) – Douglas A. Skoog, Donald M. West, F. James Holler e Stanley R. Crouch

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Concentração molar. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/concentracao-molar. Acesso em: 04 de February de 2026.
1. [UFMG]
Uma cozinheira bem informada sabe que a água contendo sal de cozinha dissolvido ferve a uma temperatura mais elevada que a água pura e que isso pode ser vantajoso em certas preparações. Essa cozinheira coloca 117g de NaCl em uma panela grande. Assinale a alternativa que indica corretamente o volume necessário de água para a cozinheira preparar uma solução 0,25 mol/L de cloreto de sódio, NaCl.
a) 0,125 L.
b) 2,00 L.
c) 8,00 L.
d) 29,3 L.
e) 468 L.
Número de massa dos elementos:
Na = 23 u
Cl = 35,5 u
Os dados fornecidos são:
m1 = 117 g
MM1 = 23 + 35,5 = 58,5 g/mol
M = 0,25 mol/L
V = x (é o que será calculado)
Aplicando na equação:
M = m1
MM1.V
0,25 = 117
58,5 . V
V = 117
58,5 . 0,25
V = 117
14,625
V = 8,00 L
Portanto, a alternativa correta é a letra c) 8,00L.
2. [IF-SC]
Qual a molaridade (mol/L) de uma solução que contém 160 g de ácido sulfúrico (H2SO4) em 620 mL de solução? (Dado: massa molar H2SO4 = 98 g/mol)
Os dados fornecidos são:
m1 = 160 g
MM1 = 98 g/mol
V = 620 mL = 0,620 L
M = x (é o que será calculado)
Aplicando na equação:
M = m1
MM1.V
M = 160
98 . 0,620
M = 160
60,76
M = 2,65 mol/L