Os primeiros relatos e observações sobre o comportamento de ácidos e bases remontam da Idade Média, sendo em seguida aperfeiçoado pelos alquimistas. Através de observações como mudança de cor em extratos vegetais e reatividade, os alquimistas classificaram dois grupos: os ácidos (do latim acidus, que significa azedo) e base (do árabe álcali, que significa cinzas vegetais).
Publicidade
As bases estão muito presentes em nosso cotidiano, como em antiácidos, desentupidores de canos (hidróxido de sódio, NaOH), leite, legumes, frutas, detergentes, sabões, alvejantes, e entre outros. Quando dizemos que as bases estão presentes em nosso cotidiano, queremos dizer que existem produtos que se comportam como uma base em determinado meio, e este comportamento segue algumas teorias na qual atentemos para duas mais usuais: a de Arrhenius e a de Bronsted-Löwry.
Cada uma dessas duas principais teorias prevê um modo de classificar um material químico como uma base. Portanto, devemos ter em mente que uma base é sempre relativa a um determinado meio, não existe um material ácido nem básico, mas sim é analisado seu comportamento frente a um solvente.
Bases de Arrhenius
Em seu trabalho com soluções eletrolíticas, o químico sueco Svante Arrhenius (1859-1927) propôs que a característica das bases em solução aquosa seria marcada pela liberação de um íon hidroxila, OH–, logo, para haver o comportamento referente a uma base, a substância devia conter um íon OH– que em água era dissociado. Esta teoria se limita apenas em soluções aquosas e para substâncias que contém uma hidroxila. Não explica, por exemplo, o comportamento básico da amônia, NH3, uma molécula gasosa que possui comportamento básico. Portanto, a representação química para substância básicas de acordo com a Teoria de Arrhenius é da seguinte forma:
NaOH(aq)→Na+(aq) + OH–(aq)
Observamos que há uma dissociação da molécula de hidróxido de sódio, que se admite estar em água. Temos os íons sódio e hidroxila, ligados por ligação do tipo iônica. Continuando com a Teoria de Arrhenius, a reação de uma base com um ácido tem como produto sal e água, segundo seu enunciado. Assim, uma molécula de hidróxido de sódio reagindo com ácido clorídrico é representada da seguinte forma:
NaOH(aq) + HCl(aq)→NaCl(s) + H2O(l)
Publicidade
Novamente vemos que a Teoria de Arrhenius para definição de uma base é limitada, pois se admite apenas a reação de uma base com um ácido, mas não explica o que acontece quando se coloca para reagir duas bases, uma classificada como forte e outra como fraca.
As Bases de Arrhenius podem ter variável número de hidroxilas, como nos exemplos abaixo:
NaOH(aq)→Na+(aq) + OH–(aq), uma monobase, por ter uma hidroxila.
Publicidade
Fe(OH)2(aq)→Fe+2(aq) + 2OH–(aq), uma dibase, por ter duas hidroxilas.
Al(OH)3(aq)→Al+3(aq) + 3OH–(aq), uma tribase, por ter três hidroxilas.
E também podem ser classificadas em bases fortes, que são aquelas que em água se dissociam totalmente (formadas pela união de um íon hidroxila e um íon de metal alcalino ou alcalino-terroso); e as bases fracas, que em água não se dissociam totalmente (formadas pela união de íon hidroxila com os demais metais).
Embora a Teoria de Arrhenius seja restrita a sistemas que contenham apenas água, fora de grande importância para o desenvolvimento da química analítica e da eletroquímica. Convém ressaltar que não é uma explicação errada, apenas limitada ao sistema aquoso, não explicando o que acontece em sistemas com solventes, por exemplo.
Bases de Bronsted-Löwry
Trabalhando independentemente com solventes, Johannes Nicolaus Bronsted e Thomas Löwry propuseram outra forma de comportamento de bases, dessa vez frente a um solvente específico. Segundo eles, as espécies químicas envolvidas numa reação possuem pares conjugados. Assim, uma substância só será básica em relação a uma outra espécie química bem definida. Pela definição, as bases de Bronsted-Löwry são aquelas espécies químicas que recebem um próton H+. Vejamos um exemplo através da equação química que representa a reação de amônia, NH3, com água, H2O:
NH3 + H2O→NH4+ + OH–
No caso acima, houve a transferência de um próton H+ da molécula de água para a molécula de amônia NH3. Logo, a amônia se comportou como uma base por aceitar um próton H+ da molécula de água. Analisamos agora a reação inversa, ou seja, entre o íon amônio (NH+) e o íon hidroxila (OH–):
NH4+ + OH–→NH3 + H2O
No caso da reação inversa, o íon hidroxila se comporta como uma Base de Bronsted-Löwry por ter aceitado um próton do íon amônio. Podemos perceber que a Teoria de Bronsted-Löwry é mais abrangente em comparação com a de Arrhenius, pois permite avaliar o comportamento frente a duas moléculas que reagem entre si e que esteja num meio que seja diferente do aquoso.

Por Douglas Benício
Graduado em Química - Licenciatura (UEM)
Benício, Douglas. Bases. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/bases. Acesso em: 05 de February de 2026.
1. [PUC-MG] Na reação abaixo, a espécie H2Br+ é classificada como:
HBr + HNO3→H2Br+ + NO3–
a) Uma base de Lewis.
b) Uma base de Arrhenius.
c) Um ácido de Arrhenius.
d) Um ácido de Bronsted-Löwry.
e) Uma base de Bronsted-Löwry.
2. [ENEM/2012] Uma dona de casa acidentalmente deixou cair na geladeira a água proveniente do degelo de um peixe, o que deixou um cheiro forte e desagradável dentro do eletrodoméstico. Sabe-se que o odor característico de peixe se deve às aminas e que esses compostos se comportam como bases.Na tabela estão listadas as concentrações hidrogeniônicas de alguns materiais encontrados na cozinha, que a dona de casa pensa em utilizar na limpeza da geladeira.
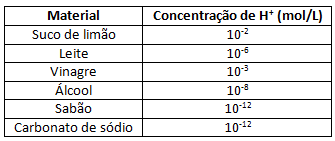
Dentre os materiais listados, quais são apropriados para amenizar este odor?
a) Álcool e sabão.
b) Suco de limão e álcool.
c) Suco de limão e vinagre.
d) Suco de limão, leite ou sabão.
e) Sabão ou carbonato de sódio.
1. [D]
A teoria ácido-base de Bronsted-Löwry nos diz que ácidos são doadores de íons H+ e bases receptores destes. Na reação acima, temos que do lado dos produtos há um íon NO3–, que se encontra desprotonado em relação a seu reagente HNO3. Este próton foi transferido para a molécula de HBr. Logo, a molécula de HBr+ é classificada como um ácido de Bronsted-Löwry porque se a reação inversa ocorrer, o próton dessa molécula irá para o íon NO3–.
2. [C]
A teoria ácido-base de Arrhenius nos diz respeito sobre o comportamento de substâncias em meio aquoso. Também nos diz que a reação entre um ácido e uma base resulta em sal e água. O enunciado diz que o cheiro de peixe é devido a presença de aminas, que em água se comportam como uma base.
Ácidos neutralizam bases.
Na tabela acima, temos os materiais com suas respectivas concentrações de íons H+, característicos de substâncias que se comportam como ácidos de Arrhenius. Quanto maior for a concentração de íons H+, mais destes íons estão em água, e assim o material pode ser classificado como ácido de Arrhenius. Logo, os maiores valores de concentração na tabela são referentes ao suco de limão e ao vinagre, sendo estes responsáveis por eliminar o odor fétido por meio de uma reação ácido-base de Arrhenius.