O conceito de ácido foi apresentado pelo químico, físico e matemático sueco Svante August Arrhenius, em 1887. De acordo com o pesquisador, os ácidos são substâncias que, em solução aquosa (qualquer solução em que o solvente é a água), aumentam a concentração de íons hidrogênio, H+(aq), na água.
Publicidade
Segundo o conceito dos químicos Johannes N. Brönsted e Thomas Lowry (Bronsted-Lowry), os ácidos podem ser definidos como substâncias capazes de doar um próton a outras substâncias.
Propriedades dos ácidos
Os ácidos, assim como as bases, estão muito presentes na nossa vida cotidiana, sendo componentes usuais de refrigerantes, medicamentos, alimentos, produtos de higiene ou de cosméticos, além de serem importantes matérias-primas para aplicações industriais.
O grupo denominado “ácidos” é formado pelas substâncias que possuem características e comportamento químico semelhantes.
As principais características dos ácidos são as seguintes:
- Em solução aquosa, os ácidos conduzem eletricidade, pois se desdobram em íons;
- Os ácidos possuem sabor azedo. Por exemplo, o limão, vinagre e tamarindo são azedos porque contêm ácidos;
- Os ácidos reagem com as bases, formando sais e água. São as denominadas reações de neutralização;
- Os ácidos mantêm incolor uma solução de fenolftaleína.
Nomenclatura dos ácidos
Os ácidos podem ser classificados em dois grupos:
1) Hidrácidos
São aqueles que não possuem oxigênio na molécula. As substâncias são formadas por hidrogênio e não metais.
Publicidade
Exemplos: HCl (ácido clorídrico), HBr (ácido bromídrico) e H2S (ácido sulfídrico)
Os nomes dos hidrácidos são obtidos da mesma forma:
Ácido + nome do elemento + ídrico
Publicidade
2) Oxiácidos
São aqueles que possuem oxigênio e não metais na molécula.
Exemplos: H2SO4 (ácido sulfúrico), HNO3 (ácido nítrico) e H3PO4 (ácido fosfórico).
Ácidos inorgânicos e equação de ionização
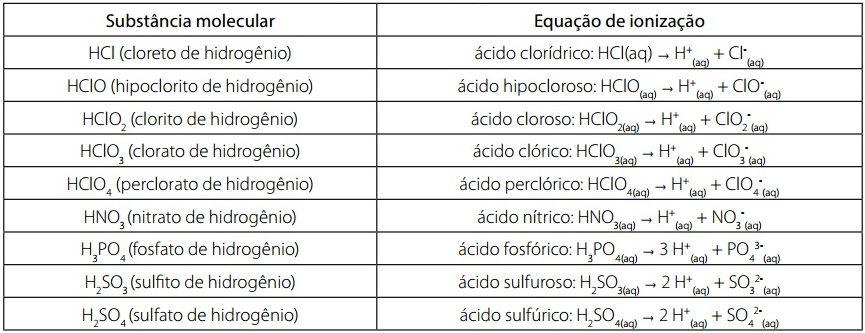
A nomenclatura dos ácidos segue os seguintes critérios:
- Quando o nome do ácido termina em “ídrico”, o nome do ânion termina em “eto”. Por exemplo: ácido clorídrico e cloreto;
- Quando o nome do ácido possui a terminação “ico”, o nome do ânion termina em “ato”. Por exemplo: ácido acético e acetato;
- Quando o nome do ácido termina em “oso”, o nome do ânion possui a terminação “ito”. Por exemplo: ácido hipocloroso e hipoclorito.
Força dos ácidos
A força dos ácidos é medida pelo grau de ionização, sendo divididos entre forte e fraco.
Confira a tabela a seguir:
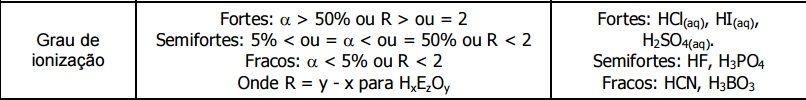
Os ácidos fortes se ionizam completamente na água, isto é, liberam íons H+, mas não os recebem. Já os ácidos fracos também liberam íons H+, porém parcialmente, estabelecendo um equilíbrio químico.
Ácidos comuns no nosso dia a dia
Ácido acético = vinagre
Ácido tartárico = uva
Ácido cítrico = limão, laranja, acerola
Ácido fosfórico = utilizado para fabricar refrigerantes à base de cola;
Ácido málico = maçã
Referências
Ácidos e Bases. Disponível em: http://tecciencia.ufba.br/acidos-e-bases
Química – Coleção Temas de Formação. Disponível em: http://www.acervodigital.unesp.br/

Por Débora Silva
Formada em Letras (Licenciatura em Língua Portuguesa e suas Literaturas) pela Universidade Federal de São João del-Rei (UFSJ), com certificado DELE (Diploma de Español como Lengua Extranjera. Produz conteúdo web, abrangendo diversos temas, e realiza trabalhos de tradução e versão em Português-Espanhol.
Silva, Débora. Ácidos. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/acidos. Acesso em: 15 de February de 2026.
1. [UFPB] Os ácidos são substâncias químicas sempre presentes no cotidiano do homem. Por exemplo, durante a amamentação, era comum usar-se água boricada (solução aquosa que contém ácido bórico) para fazer a assepsia do seio da mãe; para limpezas mais fortes da casa, emprega-se ácido muriático (solução aquosa de ácido clorídrico); nos refrigerantes, encontra-se o ácido carbônico; e, no ovo podre, o mau cheiro é devido à presença do ácido sulfídrico.
Esses ácidos podem ser representados, respectivamente, pelas seguintes fórmulas moleculares:
a) H3BO3, HCl, H2CO2 e H2SO4
b) H2BO3, HCl, H2CO3 e H2S
c) H3BO3, HClO3, H2SO3 e H2CO2
d) H2BO3, HClO4, H2S e H2CO3
e) H3BO3, HCl, H2CO3 e H2S
2. [Mack-SP] Certo informe publicitário alerta para o fato de que, se o indivíduo tem azia ou pirose com grande frequência, deve procurar um médico, pois pode estar ocorrendo refluxo gastroesofágico, isto é, o retorno do conteúdo ácido do estômago. A fórmula e o nome do ácido que, nesse caso, provoca queimação no estômago, a rouquidão e mesmo dor toráxica são:
a) Hcl e ácido clórico.
b) HClO2 e ácido cloroso.
c) HClO3 e ácido clórico.
d) HClO3 e ácido clorídrico.
e) HCl e ácido clorídrico.
1. [E]
2. [E]