Raio atômico relaciona a distância do núcleo à camada mais externa de elétrons. Usando como base o Modelo Atômico Bohr-Rutherford (na qual admite os elétrons circundando os átomos na forma de um sistema solar), é definido e encontrado em livros que o raio atômico é dado pela metade da distância de dois átomos em seu estado gasoso quando estão ligados, seja por covalência ou por atração iônica.
Publicidade
“O comprimento de ligação em uma molécula é a separação internuclear de dois átomos ligados.” (Atkins, P., Shriver, D. F., 2008)
A obtenção do cálculo do raio atômico é feito por base de estimativa, pois não é possível realizar o cálculo exato, através do método por Raios-X, onde feixes dessa radiação atravessa moléculas contidas na amostra na qual é obtida uma “imagem”, semelhante às radiografias clínicas de ossos, sendo assim possível calcular a distância de uma ligação química por meio da localização dos núcleos na imagem, dividindo por 2, temos o raio atômico de cada elemento.
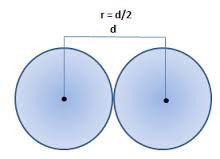
Na Figura acima temos um exemplo de como é estimado o raio atômico, dado pela fórmula:
![]()
Tendências periódicas dos raios atômicos
Ao analisar a Tabela Periódica dos Elementos, podemos estimar se um raio atômico é maior ou menor em relação aos átomos que o constituem.
Grupos (ou Famílias)
Os grupos estão organizados em colunas verticais na Tabela Periódica. Os átomos podem ter várias camadas eletrônicas, dependendo de sua configuração, ou seja, sua quantidade de elétrons. Assim, quando se desce verticalmente por um Grupo (ou por uma Família) na Tabela Periódica, observa-se um aumento de raio atômico. Tal fato é explicado por cada elemento que constitui o Grupo, há um aumento de número de elétrons em seu átomo, consequentemente há um maior número de camadas eletrônicas expandido assim a eletrosfera.
Publicidade
Períodos
Os períodos estão organizados em linhas horizontais na Tabela Periódica. Em períodos se encontram os átomos que possuem o mesmo número de níveis de energia, mas diferente número de prótons em seu núcleo. Sabemos que os prótons possuem carga positiva, enquanto os elétrons carga negativa. Dessa forma, mesmo tendo o núcleo blindado por elétrons internos, os elétrons mais externos dos átomos podem sofrer efeito de atração por parte dos prótons localizados no interior do núcleo, fenômeno chamado de carga nuclear efetiva. Com essa força de atração dos prótons pelos elétrons mais externos, há uma diminuição do raio atômico em razão do número de prótons.
O raio atômico dos elementos de um mesmo período cresce da direita para a esquerda da Tabela Periódica. Isso quer dizer que do lado esquerdo de um mesmo período, os elementos possuem menor número de prótons em relação aos do lado direito, fazendo com seu raio atômico seja maior, pois há menor atração eletrostática proporcionada pela carga nuclear efetiva.
Publicidade
Referências
ATKINS, P., SHRIVER, D. F., Química Inorgânica. 4ed. Guanabara Koogan, 2008.
Por Fernando Bortotti
Bortotti, Fernando. Raio atômico. Todo Estudo. Disponível em: https://www.todoestudo.com.br/fisica/raio-atomico. Acesso em: 02 de February de 2026.
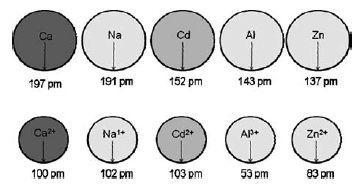
1. [ENEM/2010] O Cádmio, presente nas baterias, pode chegar ao solo quando esses materiais são descartados de maneira irregular no meio ambiente ou quando são incinerados. Diferentemente da forma metálica, os íons Cd2+ são extremamente perigosos para o organismo, pois eles podem substituir íons Ca2+, ocasionando uma doença degenerativa nos ossos, tornando-os muito porosos e causando dores intensas nas articulações. Podem ainda inibir enzimas ativadas pelo cátion Zn2+, que são extremamente importantes para o funcionamento dos rins. A figura mostra a variação do raio de alguns metais e seus respectivos cátions.
Com base no texto, a toxicidade do cádmio em sua forma iônica é consequência de esse elemento:
a) Apresentar baixa energia de ionização, o que favorece a formação do íon e facilita sua ligação a outros compostos.
b) Possuir tendência de atuar em processos biológicos mediados por cátions metálicos com cargas que variam de +1 a +3.
c) Possuir raio e carga relativamente próximos aos de íons metálicos que atual nos processos biológicos, causando interferência nesses processos.
d) Apresentar raio iônico grande, permitindo que ele cause interferência nos processos biológicos em que, normalmente, íons menores participam.
e) Apresentar carga +2, o que permite que ele cause interferência nos processos biológicos em que, normalmente, íons com cargas menores participam.
1. [C]
Para responder às assertivas, basta uma boa leitura e interpretação de textos, nada mais! Para isso, destacaremos a parte mais importante do texto que contém a resposta dada de “mão-beijada”:
“Diferentemente da forma metálica, os íons Cd2+ são extremamente perigosos para o organismo, pois eles podem substituir íons Ca2+, ocasionando uma doença degenerativa nos ossos, tornando-os muito porosos e causando dores intensas nas articulações.”
Temos acima a afirmação de que os íons cádmio podem substituir os íons cálcio. Podemos nos perguntar como poderia acontecer tal substituição. Ora, temos logo abaixo do texto uma tabela de raios atômicos de metais e seus respectivos cátions. Pela mesma tabela, podemos notar que os raios atômicos de íons Cd+2 (103pm) e Ca+ (100pm) possuem valores de diâmetro muito próximos. Por isso, os íons Cd+2 podem substituir os íons Ca+ e causa doenças degenerativas.