A ligação covalente é responsável por manter os átomos – de um mesmo ou de diferentes elementos – unidos. A consequência desse fenômeno é a matéria presente do dia a dia. Mas como essas ligações acontecem? Acompanhe a leitura para aprender o conteúdo.
Publicidade
O que é uma ligação covalente?
Antes de mais nada, é importante entender o que é uma ligação química. Ela consiste em uma atração bem forte entre dois ou mais átomos, provocando a união de ambos. Quando os átomos se aproximam uns dos outros, os elétrons de um podem ser atraídos pelo núcleo do outro. Caso os átomos tenham energia suficiente e orientação adequada, pode ocorrer a formação de uma ligação.
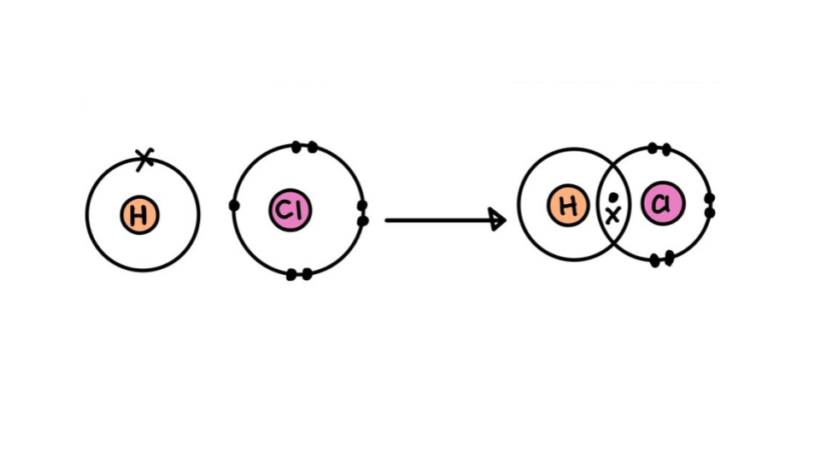
Após definir o que é uma ligação química, fica mais fácil entender o que é a ligação covalente. Ela ocorre por meio do compartilhamento de pares de elétrons entre os átomos. Dessa forma, cada átomo contribui com um elétron formando, assim, um par, que passa a pertencer a ambos. Esse tipo de ligação é comum entre os elementos químicos:
- Não metais: a maioria é gasoso e não possui caráter metálico, como carbono, iodo e bromo.
- Semimetais: são os elementos com propriedades intermediárias entre metais e não metais, como boro e silício.
A ligação covalente está presente na maioria dos compostos do cotidiano. Muitos materiais, como ar, água, madeira, plástico e outros, são formados pela união dos átomos que compartilham seus elétrons entre si. Continue a leitura para entender esse fenômeno.
Relacionadas
Como ocorre a ligação covalente?
Assim como os amigos dividem a conta em uma pizzaria, na ligação covalente, os elétrons são compartilhados pelos átomos participantes. De acordo com a regra do octeto, para que os átomos se tornem estáveis, eles devem conter 8 elétrons na camada de valência (ou 2, no caso do hidrogênio, hélio, lítio e berílio).
Dessa forma, a ligação covalente ocorre quando há um equilíbrio entre as forças de atração e repulsão entre o núcleo e os elétrons dos átomos envolvidos. Em resumo, o núcleo de um átomo exerce atração sobre os elétrons do outro, e vice-versa, como se fossem dois ímãs de polos contrários.
Publicidade
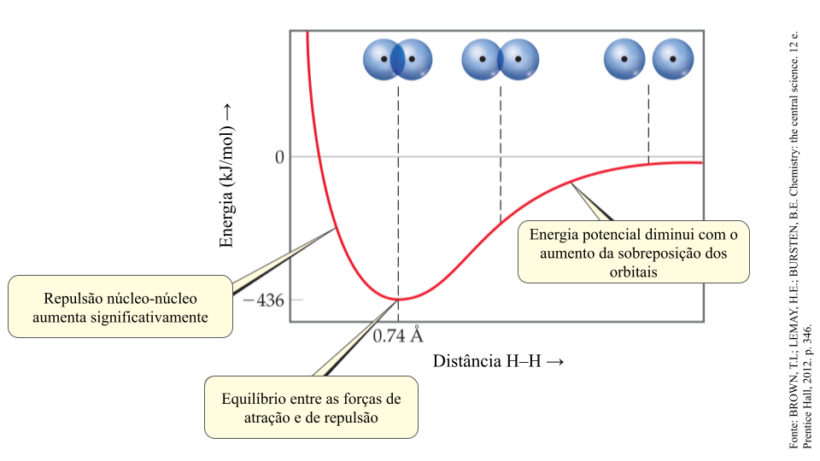
Conforme os átomos se tornam mais próximos, os núcleos começam a se repelir, assim como os elétrons presentes na eletrosfera. Caso a distância entre os núcleos continue a diminuir, a energia desse sistema aumenta muito e provoca a separação dos átomos sem que ocorra a ligação.

Publicidade
Portanto, o efeito de repulsão precisa ser compensado pela atração entre um dos núcleos e os elétrons do outro para criar uma distância ideal à ligação. Mas será que o compartilhamentos dos elétrons sempre será igual para os dois átomos? Acompanhe no próximo tópico.

Características das ligações covalentes
Compostos formados por ligações covalentes são denominados moleculares e apresentam características que os diferenciam dos compostos iônicos ou metálicos, por exemplo. Abaixo, conheça as particularidades das ligações covalentes.
- Estado físico: variável (sólido, líquido ou gasoso).
- Ponto de fusão: baixo.
- Maleabilidade: variável.
- Brilho: variável.
- Condutividade elétrica: baixa ou ausente.
- Condutividade térmica: baixa.
- Estrutura tridimensional: de cristalina a amorfa.
Por meio dessas informações, é possível, apenas, fazer comparações de uma amostra com outros compostos e supor se tratar de um material molecular. Para confirmar, será necessário fazer análises mais específicas, por exemplo, com a composição química do componente.
Tipos de ligação covalente
Nem todas as ligações covalentes são iguais. Algumas delas podem ser mais fortes ou mais fracas, mais curtas ou mais longas, polares ou apolares. Abaixo, conheça as características dos diferentes tipos de ligação covalente.
Ligação covalente simples
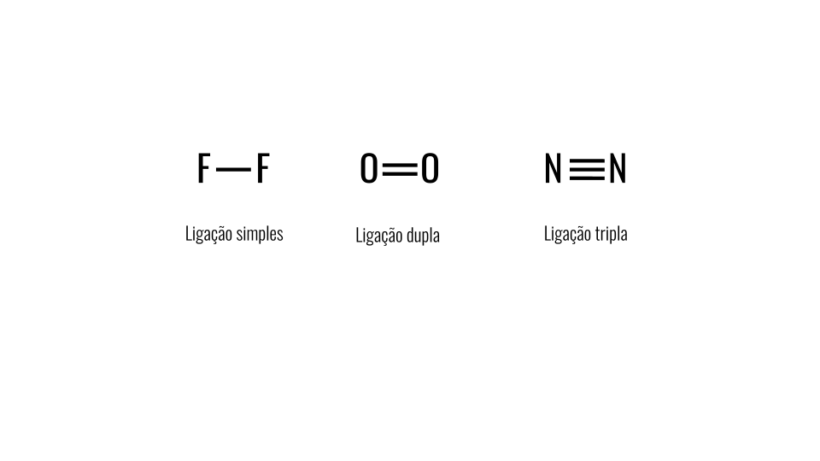
Consiste em uma ligação formada pelo compartilhamento de apenas um par de elétrons – cada um é proveniente de um dos átomos envolvidos. Esse tipo de ligação é chamada de sigma, pois ocorre pela sobreposição dos orbitais atômicos em um mesmo eixo.
Ligação covalente dupla
Consiste no compartilhamento de 2 pares de elétrons. Assim, a covalente dupla é formada por uma ligação sigma (mais forte) e por uma ligação pi (mais fraca). Ainda, ocorre a sobreposição lateral dos orbitais atômicos, que ficam paralelos entre si, resultando em uma ligação mais forte do que a simples.
Ligação covalente tripla
Consiste no compartilhamento de 3 pares de elétrons entre os átomos participantes. A covalente tripla é formada por uma ligação sigma e por duas ligações pi. Ela é mais forte do que as anteriores, visto que os átomos se unem por três ligações ao invés de apenas duas ou uma.
Ligação covalente coordenada (dativa)
Trata-se de um caso especial da ligação covalente. Nesse caso, o par de elétrons utilizado para estabelecer a ligação é proveniente de apenas um dos átomos envolvidos. Após formada, as características da ligação continuam sendo covalente.

Você acabou de conhecer os tipos de ligações covalentes. Como visto, elas se tornam mais fortes gradualmente, isto é, da simples à tripla. No próximo tópico, veja como representar cada ligação.
Como representar as ligações covalentes
Existem diferentes formas para representar as ligações covalentes, entretanto a mais recomendada (inclusive por órgãos internacionais relacionados à simbologia química) destaca alguns aspectos dos átomos. Considerando essa informação, abaixo, conheça as formas de representação para cada um dos quatro tipos de ligação covalente:
Fórmula da ligação covalente simples
A ligação pode ser representada por um par de pontos (:) entre os símbolos dos átomos (H : H). Os pontos representam o par de elétrons que estabelece a ligação entre os átomos.
Fórmula da ligação covalente dupla
A ligação dupla pode ser representada por dois pares de pontos (: :) entre os símbolos dos átomos (:Ö : : Ö:). Esse tipo de representação é denominado estrutura de Lewis. Os pares de elétrons que participam da ligação são chamados de ligantes e os que não participam, de não ligantes.
Fórmula da ligação covalente tripla
A ligação tripla pode ser representada por 3 pares de pontos (: : :) entre os símbolos dos átomos (:N : : : N:).
Fórmula da ligação covalente coordenada
Esse tipo de ligação é tradicionalmente representado por uma seta (→), que parte do átomo doador do par de elétrons em direção ao átomo receptor.

A covalente é um dos tipos de ligação mais fortes na natureza e requer bastante energia para ser rompida. No próximo tópico, continue estudando sobre o assunto.
Vídeos sobre os diferentes casos envolvendo ligações covalentes
Aproveite uma seleção de videoaula para aprender mais sobre a ligação covalente e suas características. Você acompanhará casos clássicos envolvendo os 3 tipos de ligação, bem como exemplos sobre a dativa.
Ligação covalente: resumo
Em uma abordagem geral, o professor apresenta os 4 tipos de ligação covalente. Para explicar a formação das ligações, ele recorre à regra do octeto, que define a estabilidade dos átomos. Com uma metodologia bastante lúdica, o professor dá uma aula ilustrativa e fácil de acompanhar.
Ligações covalentes: conceito e características
Com esse videoaula, você aprenderá mais sobre a ligação covalente e sua relação com a regra do octeto. Por meio das estruturas de Lewis, os professores exemplificam as três ligações. Para encerrar, é apresentada a classificação dos compostos em relação à quantidade de ligações que os átomos estabelecem.
Ligação covalente dativa: passo a passo
Talvez um dos conceitos mais complicados no que se refere às ligações químicas, porém, nesse vídeo, a ligação coordenada é apresentada de forma simples. O professor usa como exemplo o SO2 – um dos casos em que o enxofre estabelece esse tipo de ligação. Acompanhe!
Depois dessa aula sobre ligações covalentes, talvez você enxergue o mundo a sua volta com uma visão mais química das coisas, imaginando o formato das estruturas moleculares e como os materiais interagem. Para arrasar nos estudos e deixar seu cotidiano ainda mais interessante, estude sobre as propriedades da matéria!
Referências
BROWN, T.L; LEMAY, H.E.; BURSTEN, B.E. Chemistry: the central science. 12 e. Prentice Hall, 2012. p. 296–297, 346.
FELTRE, R. Química. Vol. 1. 6. ed. São Paulo: Moderna, 2004. p. 143-150.
SANTOS, W.L.P.; MOL, G.S. Química cidadã. v. 1. 2. ed. São Paulo: Editora AJS, 2013. p. 238-240.

Por Ademar Vinicius Fagion Freitas
Graduando em Química pela Universidade Estadual de Maringá (UEM), com ênfase na área de ensino. Atua como professor de química no setor privado e como voluntário no Cursinho UEM. Curte ler, assistir filmes e séries nas horas vagas.
Fagion Freitas, Ademar Vinicius. Ligação covalente. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/ligacao-covalente. Acesso em: 23 de April de 2024.
1. [UFPA]
Os átomos dos elementos se ligam uns aos outros através de ligação simples, dupla ou tripla, procurando atingir uma situação de maior estabilidade, e o fazem de acordo com a sua valência (capacidade de um átomo ligar-se a outros), conhecida através de sua configuração eletrônica. Assim, verifica-se que os átomos das moléculas H2, N2, O2, Cl2 estão ligados de acordo com a valência de cada um na alternativa:
a) N ≡ N, O = O, Cl – Cl, H – H
b) H – H, N ≡ N, O – O, Cl = Cl
c) N ≡ N, O – O, H = H, Cl = Cl
d) H – H, O ≡ O, N – N, Cl = Cl
e) Cl – Cl, N = N, H = H, O ≡ O
Alternativa correta: A.
Justificativa: o nitrogênio se encontra na família 15 da tabela periódica, portanto possui 5 elétrons em sua camada de valência. Assim, para completar o octeto, são necessários 3 elétrons. Como consequência, 2 átomos de nitrogênio se unem, por meio de uma ligação tripla, e cada um compartilha 3 elétrons.
O oxigênio se encontra na família 16 e possui 6 elétrons na camada de valência. Para completar o octeto, 2 átomos de oxigênio compartilham 2 elétrons de cada, formando uma ligação dupla.
O cloro se encontra na família 17 e possui 7 elétrons na camada de valência. Para completar o coteto, 2 átomos de cloro compartilham 1 elétron de cada, formando uma ligação simples.
O hidrogênio se encontra na família 1 e possui 1 elétron na camada de valência. Diferentemente dos casos anteriores, ele se torna estável com apenas 2 elétrons na camada de valência. Assim, 2 átomos de hidrogênio compartilham 1 elétron cada, formando uma ligação simples.
2. [FEI-SP]
Dentre os compostos a seguir, indique qual deles apresenta apenas ligações covalentes normais:
a) SO3
b) NaCl
c) NH3
d) O3
e) H2SO4
Alternativa correta: C.
Justificativa: o átomo de enxofre na molécula de SO3 necessita de apenas 1 ligação dupla para completar o octeto. Como existem 3 pares de elétrons não ligantes ao redor desse átomo, 2 deles formam uma ligação coordenada com 2 átomos de oxigênio.
O composto NaCl realiza ligação do tipo iônica, pois Na consiste em um metal pouco eletronegativo e Cl consiste em um ametal bastante eletronegativo.
No caso do composto NH3, o átomo de nitrogênio necessita de 3 elétrons para completar o coteto e cada hidrogênio de apenas 1 elétron. Dessa forma, ocorre a formação de uma ligação covalente simples entre o nitrogênio e cada um dos átomos de hidrogênio.
Na molécula de O3, ocorre a formação de uma ligação coordenada, pois o átomo de oxigênio necessita realizar apenas uma ligação dupla para se tornar estável. Então, dois átomos de oxigênio se unem. Como há 3 pares de elétrons não ligantes ao redor dos átomos de oxigênio, um dos pares de um dos átomos realiza uma ligação coordenada com um terceiro átomo de oxigênio, formando esse composto.
Assim como no composto (a), na molécula de H2SO4, o átomo de enxofre realiza duas ligações simples com dois átomos de oxigênio e duas ligações coordenadas com outros dois átomos de oxigênio.