Gases nobres são elementos da família 8A (ou família 18) que se apresentam como gases em temperatura ambiente. Constituídos por átomos livres, recebem o nome de monoatômicos, não são encontrado em forma molecular, combinado com outro átomo do mesmo elemento.
Publicidade
O termo nobre provém de uma analogia feita por seus estudiosos referente à primeira descoberta no século XVIII, pois naquela época a nobreza era reclusa evitando pessoas comuns. Após sua descoberta, os estudiosos perceberam que estes gases não eram combinados com outros elementos químicos e cunharam o termo. Tal fato se explica pela baixa reatividade ocasionada pela baixa afinidade eletrônica e alta energia de ionização.
“Gases nobres têm configurações eletrônicas muito estáveis, são excepcionalmente inativos.” (Brown, T., 2009)
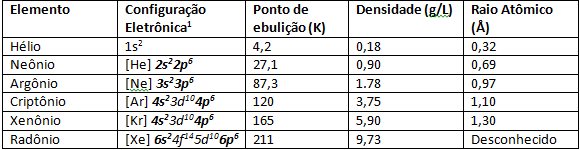
Isso ocorre devido os elementos da família 8A possuírem configuração eletrônica da camada de valência estável igual a ns2np6, dando oito elétrons. A exceção é o elemento Hélio, que possui configuração ns2. Com as camadas de valência preenchidas, resulta aos gases nobres terem afinidade eletrônica baixa. Também possuem maiores energias de ionização, esta ligada diretamente ao raio atômico que, em gases nobres, o diâmetro entre a última camada de valência ao núcleo do átomo é menor, consequentemente à medida que aumenta o período da família 8A, isto é, descendo a Tabela Periódica, a energia de ionização diminui.
Ao longo da história, vários gases foram sendo descobertos, sendo o primeiro gás nobre identificado em 1868 com o exame da cromosfera do Sol, recebendo o nome de Hélio; em 1895 foi descoberto o argônio por meio de exame de densidade dos gases que compõem a atmosfera; em 1898 quatro novos gases nobres foram identificados: Criptônio, Radônio, Neônio e Xenônio.
Os gases nobres com sua característica de baixa reatividade ajudaram na elucidação da estrutura eletrônica da matéria, pois os cientistas até então tentavam preparar compostos com estes gases, mas não obtiveram sucesso. Sendo assim, em 1916, Gilbert Lewis propôs a Regra do Octeto, que é enunciada como um octeto de oito elétrons na camada de valência é a configuração mais estável para qualquer átomo pois não causava reatividade com outros elementos.
Examinando mais a fundo, percebemos que os gases nobres, com exceção do Hélio, possuem configuração ns2np6, exatamente 8 elétrons em sua camada de valência. Logo, a regra do octeto simbolicamente postula que os elementos químicos para adquirirem estabilidade e não reagirem precisa ter sua última camada com configuração de um gás nobre.
Publicidade
Pensava-se que os gases nobres fossem compostos inertes, ou seja, não reagiam com nenhum outro tipo de elemento. No entanto, no ano de 1962 foi sintetizado o primeiro composto conhecido contendo um gás nobre pela reação entre o Xenônio, Xe, e o composto de Flúor PtF6, resultando em compostos moleculares do tipo XeF2, XeF4 e XeF6.
1. Propriedades físicas e químicas
Os gases nobres possuem pontos de fusão e ebulição muito baixos, devido sua fraca força interatômica. Em condições normais de temperatura e pressão, são elementos gasosos. Descendo pela Tabela Periódica na família 8A, o raio atômico dos elementos vai aumentando devido ao número de elétrons que também aumenta. Uma consequência observável do aumento do raio atômico é a energia de ionização, em elementos mais na base da família 8A como Xenônio e Criptônio é mais fácil arrancar um elétron de sua última camada de valência devido ao aumento do raio atômico, por isso os cientistas conseguiram sintetizar elementos como XeF4.
Na figura abaixo, temos as cores dos gases nobres quando são submetidos à descarga elétrica, fazendo com que ocorram transições eletrônicas tendo, consequentemente, emissão de cores em diferentes comprimentos de onda.
Publicidade

Referências
BROWN, T., LEMAY, E., BURSTEN, B., Química: a ciência central. 9 ed. Prentice-Hall, 2005.
ATKINS, P.W., JONES, Loretta. Princípios de química: questionando a vida moderna e o meio ambiente. 3.ed. Porto Alegre: Bookman, 2006.

Por Douglas Benício
Graduado em Química - Licenciatura (UEM)
Benício, Douglas. Gases nobres. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/gases-nobres. Acesso em: 24 de April de 2024.
1. No ano de 2012, completam-se 50 anos da perda da “nobreza” dos chamados gases nobres, a qual ocorreu em 1962, quando o químico inglês Neil Bartlett conseguiu sintetizar o Xe[PtF6] ao fazer reagir xenônio com um poderoso agente oxidante, o hexafluoreto de platina, PtF6.
Esses gases eram chamados assim, pois, na época de sua descoberta, foram julgados como sendo não reativos, ou inertes, permanecendo “imaculados”.
A explicação para a não reatividade dos gases nobres se fundamentava:
a) Na regra do dueto, segundo a qual a configuração de dois elétrons no último nível confere estabilidade aos átomos.
b) Na regra do octeto, segundo a qual a configuração de oito elétrons no penúltimo nível confere estabilidade aos átomos.
c) Na regra do octeto, segundo a qual a configuração de oito elétrons no último nível confere estabilidade aos átomos.
d) Na regra do dueto, segundo a qual a configuração de dois elétrons no penúltimo nível confere estabilidade aos átomos.
2. [UNEMAT/2012] Do Hélio, que tem Z = 2 e pertence à família dos gases nobres, é correto afirmar que:
a) Possui camada de valência completa.
b) Da ligação entre seus átomos resultam moléculas de fórmula H2.
c) Está no 2º período da tabela periódica.
d) É isoeletrônico do H1+, cujo átomo tem Z = 1.
e) Não possui camada de valência.
1. [C]
A explicação da baixa reatividade dos gases nobres se fundamenta pela regra do octeto, ou seja, é preciso que os elementos tenham oito elétrons em sua última camada para adquirirem estabilidade. No caso dos gases nobres, todos, com exceção do hélio, têm configuração na última camada do tipo ns2np6.
2. [A]
O próprio enunciado já diz que o Hélio pertence à família dos gases nobres. Gases nobres são muito estáveis por terem camada de valência completa, formando assim o octeto de elétrons.