Uma situação de equilíbrio químico acontece quando há a proporção constante entre os produtos e os reagentes de uma reação química durante o desenrolar do tempo. Claude Louis Berthollet foi o primeiro a estudar esse fenômeno, publicado em seu livro Essai de statique chimique no ano de 1803.
Publicidade
Reações químicas
Na teoria, as reações químicas acontecem em dois sentidos: os reagentes que se tornam produtos, e os produtos que se tornam reagentes novamente. Existem, entretanto, algumas reações, em que 100% dos reagentes são convertidos em produtos sem que haja o contrário, como é o caso da combustão. Essas reações recebem o nome de irreversíveis, mas existem ainda aquelas em que há uma quantidade determinada de produtos formada que começam a dar origem aos reagentes, e recebem o nome de reversíveis. Quando falamos de equilíbrio químico, estamos relacionando diretamente às reações reversíveis.
Por mais que as reações tenham concentrações de reagentes e produtos constantes em um equilíbrio químico, os fenômenos inverso e direto do processo reversível continuam acontecendo na mesma velocidade. Elas se anulam, o que faz com que, apesar de a reação nunca ser interrompida, as concentrações de produto e de reagente se mantenham constantes.
O que são reações reversíveis?
Como mencionamos anteriormente, as reações reversíveis são aquelas que acontecem em dois sentidos, como é o caso da produção da Amônia, por exemplo, a partir do gás hidrogênio e do gás nitrogênio.
![]()
A seta dupla no meio da reação representa justamente essa reação reversível, indicando que ela acontece nos dois sentidos, e g como subscrito, indica a fase gasosa, estado em que as substâncias se encontram. Nessa reação, observamos as moléculas de nitrogênio e de hidrogênio geraram, ao colidirem, as moléculas de amônia.
Quando há o início do processo, temos somente a mistura entre hidrogênio e o nitrogênio, a chance que há de as moléculas dos reagentes colidirem, é a máxima da reação, que faz com que a velocidade com que a reação acontece também seja. Quando a reação começa e se processa, há a redução das moléculas de reagentes, de forma que diminui as chances de haver a colisão, diminuindo, portanto, a velocidade da reação. Com o avançar da reação, entretanto, há também o aumento do número de moléculas de amônia, de forma que fica mais fácil haver o choque entre as moléculas de amônia, que acabam voltando a formar o hidrogênio e o nitrogênio, aumentando a velocidade nesse sentido da reação. Chegará um momento em que haverá o equilíbrio, tendo os dois sentidos da reação a mesma velocidade, sem que hajam mais variações. Nesse ponto chegamos ao equilíbrio químico.
Publicidade
Constante de equilíbrio
Quando há o equilíbrio entre os reagentes e os produtos, este, não necessariamente deverá ser 1:1m podendo ter proporções mais diversas, que são descritas por uma relação matemática. Considerando a reação:
![]()
Temos que A, B, Y e Z são as espécies químicas e a, b, y e z são os coeficientes estequiométricos. A fórmula que representa a proporção no equilíbrio entre essas espécies envolvidas é:
Publicidade
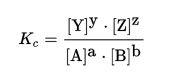
Os colchetes representam o valor da concentração representada dentro dele, enquanto Kc é uma grandeza chamada de constante de equilíbrio da reação.
Referências
Analogias no ensino do equilíbrio químico – A Raviolo, A Garritz
Química para o ensino médio – EF Mortimer, AH Machado

Por Natália Petrin
Formada em Publicidade e Propaganda. Atualmente advogada com pós-graduação em Lei Geral de Proteção de Dados e Direito Processual Penal. Mestranda em Criminologia.
Petrin, Natália. Equilíbrio químico. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/equilibrio-quimico. Acesso em: 19 de April de 2024.
01. [FATEC] Nas condições ambientes, é exemplo de sistema em estado de equilíbrio uma:
a) xícara de café bem quente;
b) garrafa de água mineral gasosa fechada;
c) chama uniforme de bico de Bunsen;
d) porção de água fervendo em temperatura constante;
e) tigela contendo feijão cozido.
02. [UFAL] Na expressão da constante de equilíbrio da reação H2(g) + Br2(g) D 2 HBr(g) estão presentes as concentrações em mol/L das três substâncias envolvidas. Isto porque a reação:
a) envolve substâncias simples, como reagentes;
b) envolve moléculas diatômicas;
c) envolve moléculas covalentes;
d) se processa em meio homogêneo;
e) se processa sem alteração de pressão, a volume constante.
01. [B]
02. [D]