Quando falamos em eletronegatividade de um determinado elemento, estamos falando sobre a capacidade que um núcleo de um determinado átomo possui de atração com relação aos elétrons que estão envolvidos em uma determinada ligação química. Quando dois átomos se unem, compartilham pares de elétrons que estão presentes em suas últimas camadas de valência, de modo que há interação elétrica entre os núcleos desses átomos, assim como entre os elétrons das camadas de valência dos elementos.
Publicidade
Para exemplificar, confira a ilustração que refere-se a formação da molécula de CO2. O carbono, átomo central, está compartilhando dois pares de elétrons com cada um dos átomos de oxigênio, e os seus átomos, portanto, estão atraindo elétrons que estão envolvidos nessas ligações.
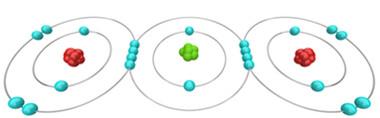
É bastante claro, entretanto, para os estudiosos da área, que a força de atração de cada átomo com relação aos elétrons é diferente, variando de acordo com o elemento. Podemos dizer, por exemplo, que o átomo de oxigênio é mais eletronegativo que o átomo de carbono, atraindo, portanto, elétrons da ligação com uma força maior do que o carbono.
Como saber qual a eletronegatividade de um elemento?
Mas então, sabendo que elementos podem ter eletronegatividades diferentes, como saberemos definir isso? Trata-se de uma propriedade periódica sendo, portanto, o seu aumento ou diminuição observados em intervalos regulares na tabela periódica, variando de acordo com o aumento ou com a diminuição do número atômico dos elementos. Segundo Linus Pauling, cientista, a eletronegatividade dos elementos pode ser definida conforme a tabela abaixo.
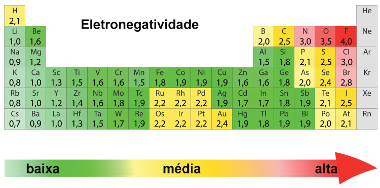
Segundo a tabela acima, podemos observar que os elementos que pertencem à mesma família apresentam eletronegatividade aumentando de baixo para cima. Esse sentido é o contrário, como vale ressaltar, do crescimento do raio atômico, que também é uma propriedade periódica. As duas, entretanto, estão diretamente relacionadas, já que quando há um aumento no número atômico entre os elementos de uma mesma família, haverá também um aumento nesse sentido no número de camadas eletrônicas e no tamanho ou raio atômico.
Quanto maior for o raio atômico, entretanto, mais distante estará o núcleo da camada de valência, fazendo com que haja uma diminuição na atração entre as cargas positivas do núcleo, denominadas prótons, e as cargas negativas da camada de valência, denominadas elétrons. Diante disso, podemos dizer que há uma diminuição da eletronegatividade.
Se observarmos, entretanto, os elementos da tabela periódica que pertencem ao mesmo período, ou seja, que pertencem à mesma linha, é possível notar que a eletronegatividade cresce da esquerda para a direita. Confira:
Publicidade

Todos os elementos de um determinado período possuem a mesma quantidade de camadas eletrônicas, portanto isso está relacionado também ao raio atômico. Quando o número atômico vai aumentando da esquerda para a direita, a quantidade de prótons presentes no núcleo também aumenta, de forma que a atração fica mais intensa, diminuindo o raio atômico. Nesse caso, entretanto, há um aumento da eletronegatividade.
Linus Pauling criou uma escala de elementos mais eletronegativos, e isso pode ajudar a determinar a intensidade da polarização de diferentes ligações. Confira:
F > O > N > Cl > Br > I > S > C > P > H
Existe uma frase para ajudar a lembrar dessa fila de eletronegatividade, confira: Fui Ontem No Clube, Briguei i Saí Correndo Para o Hospital”.
Publicidade
Referências
Química – Márcio Pugliesi, Diamantino Fernandes Trindade

Por Natália Petrin
Formada em Publicidade e Propaganda. Atualmente advogada com pós-graduação em Lei Geral de Proteção de Dados e Direito Processual Penal. Mestranda em Criminologia.
Petrin, Natália. Eletronegatividade. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/eletronegatividade. Acesso em: 25 de April de 2024.
01. [ENEM] Os elementos químicos A, B, C, D e E apresentam os números atômicos 26, 11, 9, 3 e 7, respectivamente. Qual alternativa apresenta a sequência decrescente de eletronegatividade?
a) 7, 11, 3, 26, 9
b) 7, 26, 11, 3, 9
c) 9, 3, 11, 26, 7
d) 9, 7, 26, 3, 11
e) 7, 9, 11, 26, 3
02. [ENEM] O elemento químico mais eletronegativo do 3° período da tabela periódica é o:
a) Na
b) Ar
c) Cl
d) B
e) TI
01. [D]
02. [C]